-
绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂。工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为_______(填>、<、=)40%。
(2)将111.2g绿矾(FeSO4∙7H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为_______g;SO2为_______mol。实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
(3)将4.88g铁屑(含Fe2O3)与25mL 3mol/L H2SO4充分反应后,得到FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。铁屑中Fe2O3的质量分数是________(保留两位小数)。
(4)向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。t℃时,计算(NH4)2SO4·FeSO4·6H2O的溶解度。_______(保留两位小数)。
高三化学计算题中等难度题查看答案及解析
-
绿矾(FeSO4•7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为______(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为______(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3•nH2O表示20%的发烟硫酸,则n=______(保留两位小数)。
(3)某厂废水中含1.00×10﹣3mol/L的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2).欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4.理论上需要加入______g FeSO4•7H2O。
(4)硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3﹣+3Cu2S+16H+→6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+→3Cu2++3 SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好与48mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3﹣+3Fe2++4H+→NO↑+3Fe3++2H2O
试计算混合物中CuS的质量分数(保留两位小数)。______________
高三化学计算题困难题查看答案及解析
-
绿矾(FeSO4•7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为______(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为______(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3•nH2O表示20%的发烟硫酸,则n=______(保留两位小数)。
(3)某厂废水中含1.00×10﹣3mol/L的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2).欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4.理论上需要加入______g FeSO4•7H2O。
(4)硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3﹣+3Cu2S+16H+→6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+→3Cu2++3 SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好与48mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3﹣+3Fe2++4H+→NO↑+3Fe3++2H2O
试计算混合物中CuS的质量分数(保留两位小数)。______________
高三化学计算题困难题查看答案及解析
-
绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为________(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+→ 3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+→ NO↑+3Fe3++2H2O
① V值范围________;
② 若V=48,试计算混合物中CuS的质量分数(保留两位小数)。
高三化学填空题困难题查看答案及解析
-
(10分)工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:▲ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为▲ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为________▲ ;
②若V=35,试计算混合物中CuS的质量分数。
高三化学填空题简单题查看答案及解析
-
(10分)工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:▲ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为▲ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为________▲ ;
②若V=35,试计算混合物中CuS的质量分数。
高三化学填空题简单题查看答案及解析
-
工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:▲ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为▲ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为________▲ ;
②若V=35,试计算混合物中CuS的质量分数。
高三化学填空题中等难度题查看答案及解析
-
(8分)工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
⑴若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:▲ 。
⑵为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为▲ 。
⑶硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为________▲ ;
②若V=35,试计算混合物中CuS的质量分数。
高三化学实验题中等难度题查看答案及解析
-
工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾.
(1)若用98% 1.84g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:________.
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00g铁粉充分反应,收集到224mL(标准状况)气体,剩余固体质量为3.88g,测得反应后的溶液中Fe2+的物质的量为0.14mol(不含Fe3+).则该样品中Fe2+离子的氧化率为________.
(3)硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液.现取0.4g Cu2S和CuS的混合物在酸性溶液中用40mL 0.150mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O,反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2mol/L (NH4)2Fe(SO4)2溶液完全反应.已知:MnO4-+Fe2++H+--Mn2++Fe3++H2O(未配平)①V的取值范围为________;②若V=35,试计算混合物中CuS的质量分数.高三化学填空题中等难度题查看答案及解析
-
(16分)工业上利用废铁屑(含少量氧化铝、氧化铁等)生产硫酸亚铁溶液,进而可制备绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)等重要试剂。生产硫酸亚铁溶液的工艺流程如下:
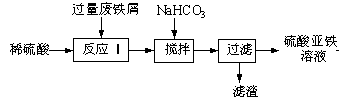
回答下列问题:
(1)加入少量NaHCO3,调节溶液pH的目的是__________________________。
(2)硫酸亚铁溶液在空气中久置容易变质,用离子方程式表示其变质的原因:_____。
(3)若向所得FeSO4溶液中加入少量3 moL• L-1 H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后得到硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)。硫酸亚铁铵较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.352g Cu2S和CuS的混合物在酸性溶液中用40.00 mL0.150 mol•L-1 KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,剩余的KMnO4恰好与50.00mL 0.200 mol•L-1 (NH4)2Fe(SO4)2溶液完全反应。
①配平离子方程式: MnO4-+ Fe2++ H+—— Mn2++ Fe3++ H2O
②Cu2S和CuS的混合物在酸性溶液中用0.150 mol•L-1 KMnO4溶液处理后,溶液需煮沸的原因是:_______________________________________________。
③实验室配制500mL 3 moL• L-1 H2SO4溶液,需要质量分数为98%,密度为1.84g• mL-1硫酸的体积为__________ mL。(保留1位小数)
④试计算混合物中CuS的质量分数(写出计算过程)。
高三化学填空题极难题查看答案及解析