-
中国科研提供抗疫“硬核力量”,在对新冠病毒的认识与防控中,化学知识起到了重要作用。下列说法不正确的是( )
A.新冠病毒DNA分子内存在氢键,氢键具有一定的方向性和饱和性
B.聚丙烯是生产医用口罩熔喷布的主要原料,其单体分子中碳原子均以sp2杂化
C.为了防止蛋白质变性,病毒疫苗一般需要冷藏存放
D.在选用酒精消毒时,75%的酒精溶液比95%的杀菌效果好
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.苯和溴水在铁作催化剂的条件可以制取溴苯
B.油酸和硬脂酸可用酸性KMnO4溶液鉴别
C.顺-2-戊烯和反-2-戊烯加氢产物不相同
D.
的名称为:2-氯-3-甲基-3-戊烯
难度: 简单查看答案及解析
-
实验室中某此气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置),用此装置和相关试剂不能制取的气体是( )
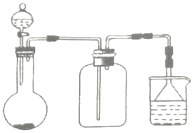
A.NH3 B.SO2 C.NO2 D.Cl2
难度: 简单查看答案及解析
-
第四周期元素中基态原子未成对电子有一个单电子的元素种数为( )
A.3 B.4 C.5 D.6
难度: 简单查看答案及解析
-
VCB是锂离子电池的一种添加剂,以环氧乙烷为原料制备的一种合成路线如图:
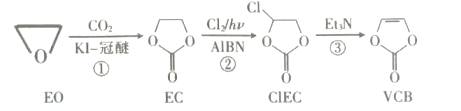
下列说法错误的是( )
A.反应①的原子利用率为100%
B.CIEC中含有一个手性碳原子
C.EO、EC的一氯代物种数相同
D.CIEC、VCB分子中所有原子均处于同一平面
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层电子数是其周期数的3倍,Z是短周期元素中原子半径最大的,0.1mol·L-1W最高价氧化物对应的水化物的水溶液pH<1。下列说法正确的是( )
A.电负性大小顺序:Y>X>Z>W
B.由于氢键的作用导致气态氢化物的稳定性X>W
C.ZY的水溶液使蓝色石蕊试纸显红色
D.Z分别与其它三种元素组成的二元化合物均含有离子键
难度: 简单查看答案及解析
-
下列对实验事实的解释错误的是( )
选项
实验事实
解释
A
实验室用粗锌与稀盐酸反应制H2比纯锌快
粗锌与稀盐酸构成原电池
B
浓硝酸保存在棕色试剂瓶中
4HNO3
2H2O+4NO2↑+O2↑
C
向10mL0.2mol·L-1ZnSO4,溶液中加入10mL0.4mol·L-1Na2S溶液,产生白色沉淀,再滴加CuSO4溶液,沉淀变黑
Ksp(CuS)<Ksp(ZnS)
D
做过银镜反应的试管可用铁盐溶液洗涤,加入稀盐酸,清洗效果更好
Fe3++Ag
Fe2++Ag+,加入盐酸,Ag+与Cl-结合成氯化银沉淀,使平衡右移
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
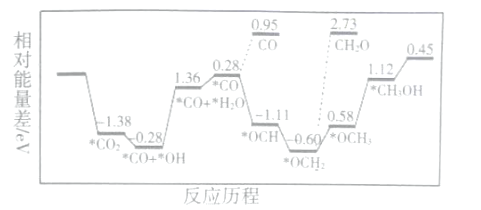
铂基催化剂表面的氧化还原反应(ORR)是燃料电池最重要的阴极反应。厦门大学李剑锋课题组模拟研究了在酸性条件下铂单晶表面的反应路径如图所示,其中吸附在铂基催化剂表面上的物种用*标注。下列说法正确的是( )
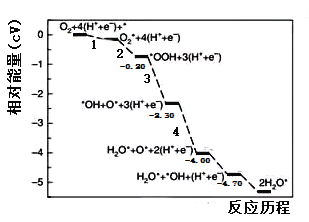
A.②为氧氧双键的断裂过程
B.过程③断裂非极性键,过程⑤形成非极性键
C.该历程的总反应式为O2+4H++4e-=2H2O
D.若在碱性条件下,铂单晶表面的ORR过程及产物均不变
难度: 简单查看答案及解析
-
实验室利用如图装置制取有机物,下列说法错误的是( )
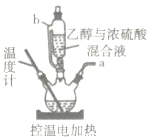
A.根据温度计读数的不同,可制取乙烯和乙醚
B.b为恒压滴液漏斗,其优点是便于液体顺利滴下
C.将产生的气体通入酸性高锰酸钾溶液,若溶液褪色,则证明有乙烯生成
D.浓硫酸在反应中的作用可能有:催化、吸水、氧化、脱水
难度: 中等查看答案及解析
-
印刷线路板废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-),可用来制备碱式碳酸铜,过程如图:
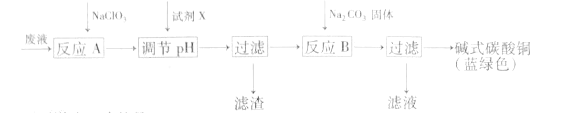
下列说法正确的是( )
A.反应A的离子方程式为:10Fe2++2ClO3-+12H+=10Fe3++Cl2↑+6H2O
B.铜在空气中被腐蚀得到铜锈,其主要成分是碱式碳酸铜
C.NaClO3和Na2CO3中心原子杂化类型均为sp3杂化
D.试剂X可为CuO,主要作用是通过调节pH值把Fe2+转化为Fe(OH)3过滤除去
难度: 中等查看答案及解析
-
将氯化氢转化为氯气的技术成为科学研究的热点,在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示。下列说法正确的是( )
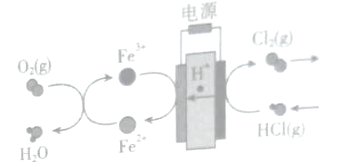
A.正极发生的电极反应为Fe3++e-=Fe2+
B.阳极反应为:2C1--2e-=Cl2↑
C.若消耗5.6L氧气,则电路中转移1mol电子
D.Fe3+在反应中起催化剂作用
难度: 中等查看答案及解析
-
硼烯具有优异的电学、力学、热学等属性,将成为继石墨烯之后又一种“神奇纳米材料”。科学家已成功合成多种结构的硼烯,如图为“皱褶”式硼烯的结构。下列说法错误的是( )

A.“皱褶”式硼烯中每个硼原子共用3对电子
B.“皱褶”式硼烯中硼原子达到8电子稳定结构
C.硼烯有望代替石墨烯作电极材料
D.氧化硼的水化物是一种弱酸,与过量OH-反应可生成B(OH)4-或BO2-
难度: 中等查看答案及解析




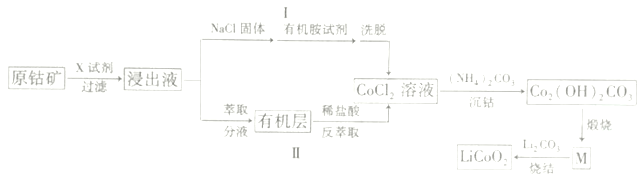
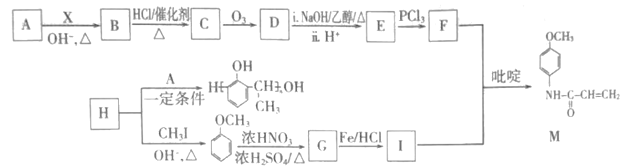
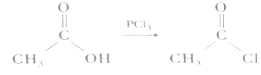
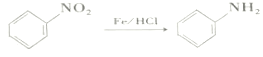 (在空气中极易被氧气氧化)
(在空气中极易被氧气氧化)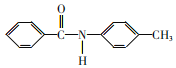 的合成路线(其它无机试剂任选)___。
的合成路线(其它无机试剂任选)___。