-
化学中有“四同”,根据“四同”的概念,下列物质间关系正确的是
A.1H2、2H2——同位素 B.HCOOCH3、CH3OCHO——同分异构体
C.S2—、S22———同素异形体 D.甲基丙烯酸、油酸——同系物
难度: 中等查看答案及解析
-
电视剧《活色生香》向我们充分展示了“香”的魅力。低级酯类化合物是具有芳香气味的液体,下列说法中,利用了酯的某种化学性质的是
A.用酒精可以提取某些花香中的酯类香精,制成香水
B.炒菜时加一些料酒和食醋,使菜更香
C.用热水洗涤碗筷去油腻比冷水效果好
D.各种水果有不同的香味,是因为含有不同的酯
难度: 中等查看答案及解析
-
Al、Fe、Cu都是重要的金属元素,下列说法正确的是
A.常温下Cu、Fe、Al均不能和浓硫酸发生化学反应
B.铝制品、铁制品、铜制品长期放置在空气中均易腐蚀
C.制备AlCl3、FeCl3、CuCl2均能采用单质与氯气反应的方法
D.铝的氧化物粉末是白色的,铁、铜的最高价氧化物粉末都是黑色的
难度: 中等查看答案及解析
-
时向
的蒸馏水中加入
晶体,保持温度不变,测得溶液的
,下列叙述错误的是
A.此时水的离子积
B.水电离出的
C.水的电离度随温度升高而升高
D.
难度: 困难查看答案及解析
-
物质①干冰②烧碱③冰醋酸④葡萄糖⑤碘⑥三氧化硫⑦钠⑧水晶⑨无水硫酸铜⑩石蜡熔化时,断裂共价键的有
A.⑧ B.⑤⑧⑨ C.②③⑥ D.③⑤⑥⑦⑧⑩
难度: 中等查看答案及解析
-
下列物质的保存方法正确的是
A.液溴置于橡胶塞的细口瓶中且用水封 B.氯气加压液化后密封在钢瓶中
C.氢氟酸置于塑料封盖的玻璃瓶中 D.少量的钠保存在酒精中
难度: 中等查看答案及解析
-
加热下列物质发生反应,反应中有两种以上元素参加氧化还原的是
A.HNO3 B.NaHCO3 C.Cu(NO3)2·6H2O D.AgNO3
难度: 中等查看答案及解析
-
以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉)。下列说法错误的是
A.溶液的pH变小 B.阴极逸出气体
C.阳极附近溶液呈蓝色 D.阴极附近溶液呈红色
难度: 中等查看答案及解析
-
其他条件不变,升高温度下列数据一定增大的是
A.碱在水中的溶解度
B.乙酸溶液的pH
C.合成氨的反应热
D.醋酸钠溶液中的氢氧根离子浓度
难度: 简单查看答案及解析
-
常温下,将一定量的氯气通入100 mL 4 mol/L的氢氧化钠溶液中,发生反应的化学方程式为:Cl2+2NaOH → NaCl+NaClO+H2O。充分反应后,下列说法正确的是(NA为阿伏加德罗常数)
A.当通入的Cl2为2.24 L时,反应中电子转移数目为0.1 NA
B.当溶液中Na+为0.4 NA时,溶液中的Cl-为0.2 NA
C.当电子转移数目为0.2 NA时,溶液质量增加14.2 g
D.当溶液质量增加7.1 g时,溶液中ClO-为0.1 NA
难度: 中等查看答案及解析
-
除去被提纯物质中的杂质,方案正确的是
编号
被提纯的物质
杂质
除杂试剂
除杂方法
A
CO2(g)
SO2(g)
饱和Na2CO3溶液、浓H2SO4
洗气
B
NaCl(s)
KNO3(s)
AgNO3溶液
过滤
C
苯
苯酚
浓溴水
过滤
D
苯
甲苯
KMnO4(酸化),NaOH溶液
分液
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.NO2通入FeSO4溶液中 B.NH3通入AlCl3溶液中
C.CO2通入CaCl2溶液中 D.SO2通入Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
以下实验所用的试剂不合理的是
选项
实验目的
所用试剂
A
比较Fe3+和Cu2+的氧化性
FeCl3溶液和Cu
B
比较镁和铝的金属性
MgCl2溶液、AlCl3溶液、NaOH溶液
C
比较硫和氯的非金属性
氢硫酸、氯气
D
比较苯酚和碳酸的酸性
0.1mol/L苯酚钠、0.1mol/L碳酸钠溶液、pH试纸
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
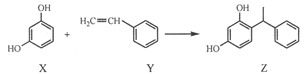
下列叙述错误的是
A.X、Y和Z均能使溴水褪色
B.X和Z均能与NaHCO3溶液反应放出CO2
C.Y既能发生取代反应,也能发生加成反应
D.Y可作加聚反应单体,X可作缩聚反应单体
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.KW/c(H+)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3-、Cl-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
难度: 中等查看答案及解析
-
向等物质的量浓度的NaOH和Na2S的混合溶液中加入稀硫酸,下列离子方程式与事实不相符的是
A.OH-+S2-+2H+→HS-+H2O B.2OH-+ S2- +4H+→H2S↑+2H2O
C.2OH-+ S2-+3H+→HS-+2H2O D.OH-+ S2-+3H+→H2S↑+ H2O
难度: 中等查看答案及解析
-
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应C(s)+CO2(g)
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
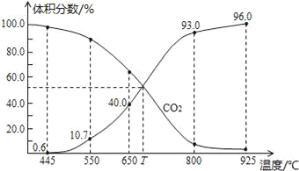
已知气体分压(P分)=气体总压(P总)×体积分数,下列说法不正确的是
A.550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向不移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04P总
难度: 中等查看答案及解析
-
已知H2S能定量完成下列反应:R-+H2S(少量)
HR + HS-, 2Z-+ H2S(少量)
2HZ + S2-。下列叙述正确的是
A.相同温度下电离平衡常数:Ki1(H2S)>Ki(HZ)>Ki2(H2S)>Ki(HR)
B.结合H+的能力:Z->S 2->R->HS-
C.同温同浓度下,溶液的pH值:NaHS>NaR>Na2S>NaZ
D.HZ与Na2S反应的离子方程式:HZ +S2-
HS-+ Z-
难度: 中等查看答案及解析
-
将一定量的H2、CO和CO2的混合气体通入盛有足量Na2O2粉末(Na2O2体积忽略不计)的密闭容器中,用电火花引燃直至反应完全。恢复到原温度,容器内的压强为原来的1/4,则原混合气体的平均相对分子质量可能是
A.20 B.23 C.30 D.36
难度: 困难查看答案及解析
-
冶铁的原料有铁矿石、焦炭、空气和石灰石。测得某冶铁高炉煤气的体积分数为CO-0.28;CO2-0.10; N2-0.58,棕色烟尘-0.04(不含氮元素)。若每生产1000kg生铁排放煤气2400 m3,则至少需要补充空气(空气体积分数:N2-0.8 、O2-0.2;气体都在同温同压下测定)
A.1392 m3 B.1740 m3 C.1920 m3 D.2304 m3
难度: 简单查看答案及解析
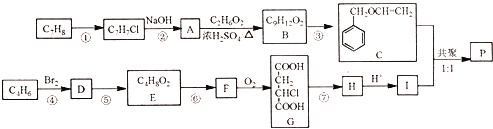
 的合成路线(无机原料任选).________(合成路线的常用表示方法为:A
的合成路线(无机原料任选).________(合成路线的常用表示方法为:A