-
(1)“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g)+H2O(g) CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| | CO | H2O | CO2 | CO | |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 650 | 2 | 1 | A | B | t |
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为_________
②A=_________
③平衡常数:K(900℃)_________K(650℃) (填“>”、“<”或“=”).
(2)温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是___________。
(3)下列描述中能说明上述反应已达平衡的是___________________
a.v正(CO)=v逆(H2) b.气体的密度不随时间而变化
c.H2和CO2的比例保持不变 d.气体的压强不再发生变化
(4)C、H、O、N元素中,写出两两组合(不能重复)形成的非极性分子的电子式_________,极性分子的电子式_________。这四种元素形成的化合物_________(填“一定是”、“一定不是”、“不一定是”)离子化合物。
-
(本题共12分)氨是一种重要的化工产品。“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
完成下列填空:
23.恒温恒容条件下,能说明该反应达到平衡状态的是 (填字母序号)。
a.ν(CO)消耗 = ν(H2O)生成 b.c(CO2) = c(CO)
c.混合气体的总压不再改变 d.混合气体的密度不再改变
24.将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| | CO | H2O | CO2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 650 | 2 | 1 | A | B | t |
| | | | | | |
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为 。
②A = 。
③平衡常数:K(900℃) K(650℃) (填“>”、“<”或“=”=)。
25.温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是 。
26.C、H、O、N元素中,核外电子占据5个不同轨道的原子,其最外层电子排布式是 。这四种元素形成的化合物 (填“一定是”、“一定不是”、“不一定是”)离子化合物。
27.能证明碳的非金属性比硅强的事实是 (选填编号)。
a.酸性:H2CO3强于H2SiO3 b.高温下SiO2与C生成Si和CO
c.键的极性:C-H > Si-H d.熔点:金刚石 > 单晶硅
-
半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
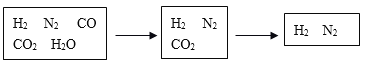
(1)步骤ⅰ,发生的是CO变换反应。
①CO变换反应的化学方程式是____________________________________。
②一定条件下,向体积固定为1 L的密闭容器中充入一定量半水煤气,发生CO变换反应。下图表示氢气与氮气的平衡体积比[V(H2):V(N2)]随外部条件X的变化关系。
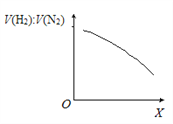
Ⅰ.X代表的物理量是______________________________。
Ⅱ.CO变换反应的△H _____0(填“>”或“<”),判断的依据是_____________________________。
③若用a、b、c、d 分别代表CO变换反应中相关化学键:H-H、H-O、 、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是
、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是 。消耗1mol CO时,该反应的热效应 △H = _______________。
。消耗1mol CO时,该反应的热效应 △H = _______________。
(2)步骤ⅱ中,用2.0 mol/L Na2CO3溶液作吸收剂脱除CO2。
①当溶液pH降至10的过程中(无沉淀析出),溶液中离子浓度关系正确的是________(选填字母)。
a.c(CO32-)+c(HCO3-) + c(H2CO3) =2.0 mol/L
b.c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)
c.c(Na+)>c(CO32-)>c(HCO3-)
②当脱除液失效时,请设计一种可使其再生的方法(结合化学方程式说明):___________________________。
-
半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。

(1)步骤I,CO变换反应的能量变化如下图所示:
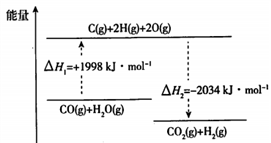
①CO变换反应的热化学方程式是________________。
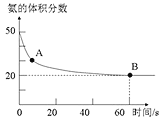
②一定条件下,向体积固定的密闭容器中充入aL半水煤气,发生CO变换反应。测得不同温度(T1,T2)氢气的体积分数ψ(H2)与时间的关系如下所示。
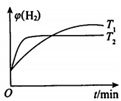
i.T1、T2的大小关系及判断理由是______________。
ii.请在上图中画出:其他条件相同时,起始充入0.5aL半水煤气,T2温度下氢气的体积分数ψ( H2)随时间的变化曲线。______________
(2)步骤Ⅱ,用饱和Na2CO3溶液作吸收剂脱除CO2时,初期无明显现象,后期有固体析出。
①溶液中离子浓度关系正确的是__________(选填字母)。
a.吸收前:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.吸收初期:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)=c(Na+)
c.吸收全进程:c(Na+)+c( H+)=2c(CO32-)+ c(HCO3-)+ c(OH-)
②后期析出固体的成分及析出固体的原因是___________。
③当吸收剂失效时,请写出一种可使其再生的方法(用化学方程式表示):____________。
-
甲醇是种非常重要的化工原料,工业上CO2 用于生产燃料甲醇,既能缓解温室效应,也为甲醇的合成寻找了新渠道。
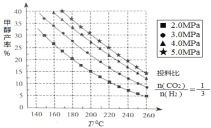
(1)甲醇的合成:合成甲醇的反应为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) △H ;在催化剂作用下,测得甲醇的产率与反应温度、压强关系如下图所示, 由图中数据可知,△H______0(选 填“>”“<”“=”),甲醇产率随着压强变化呈现图示规律的原因是_______。
(2)甲醇的应用:丙炔酸甲酯是一种重要的有机化工原料,不溶于水,常温呈液态,沸点为 103~105 ℃。实验室可用甲醇和另一有机原料 M 在一定条件下制备,实验步骤如下:
步骤 1:在反应瓶中,加入 13 g 原料 M、50 mL 甲醇和 2 mL 浓硫酸,搅拌,加热回流一段时间。
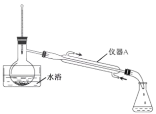
步骤 2:蒸出过量的甲醇(装置见下图)。
步骤 3:反应液冷却后,依次用饱和 NaCl 溶液、 5%Na2CO3 溶液、水洗涤;分离出有机相。
步骤 4:有机相经无水 Na2SO4 干燥、过滤、蒸馏, 得丙炔酸甲酯。
①步骤 1 中反应的化学方程式是_____________。
②步骤 1 中,加入过量甲醇的目的是_____________。
③步骤 3 中 Na2CO3 溶液洗涤主要去除的物质是______。该步骤中不用等量等浓度的NaOH 溶液代替Na2CO3 溶液洗涤主要原因是___________。
-
(14分)安对于工农业生产及国防等都具有重要意义。
(1)工业上以CO2和NH3为原料在一定条件下合成尿素的化学方程式为CO2(g)+2NH3(g)  CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
(2)合成氨的原料之一为氢气,以天然气为原料制备氢气的原理如下:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H>0
下列措施一定能使平衡体系中氢气百分含量增大的是______
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.减小压强
(3)T℃时,将1molCO和H2的混合气体与0.2molH2O(g)混合,发生反应CO(g)+H2O(g) CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
(4)在恒容密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。
CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。

(5)图乙是在一定温度和压强下合成氨反应中H2和N2的起始物质的量之比与NH3平衡体积分数的关系。图中a点的横坐标为______;若按此网站的量之比投料,达到平衡时N2的体积分数为14.5%,则a点的纵坐标为______。
-
氨气是一种重要的化工原料,在工农业中都有广泛的应用。
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入 与
与 合成尿素。在恒定温度下,混合气体中
合成尿素。在恒定温度下,混合气体中 的含量随时间的变化关系如图所示
的含量随时间的变化关系如图所示 该条件下尿素为固体
该条件下尿素为固体 。A点的正反应速率
。A点的正反应速率 ______ B点的逆反应速率
______ B点的逆反应速率 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于” ,
, 的平衡转化率为______。
的平衡转化率为______。
(2)氨基甲酸铵 是合成尿素过程中的中间产物。现将体积比为2:1的
是合成尿素过程中的中间产物。现将体积比为2:1的 和
和 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡: 。实验测得在不同温度下的平衡数据如表:
。实验测得在不同温度下的平衡数据如表:
①上述反应的焓变: ______
______ 填“
填“ ”、“
”、“ ”或“
”或“ ”,下同
”,下同 ,熵变
,熵变 ______
______ 根据表中数据,列出
根据表中数据,列出 时该反应的化学平衡常数的计算式
时该反应的化学平衡常数的计算式 ______
______ 不要求计算结果
不要求计算结果 。
。
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将______ 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 。
。
(3)向含 的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______
的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______ 填“正向”、“不”或“逆向”
填“正向”、“不”或“逆向” 移动,所滴加氨水的浓度为______
移动,所滴加氨水的浓度为______  时,
时, 的电离平衡常数
的电离平衡常数 
-
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) ⇌ CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) ⇌ NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) ⇌ CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、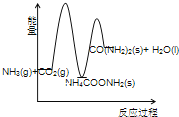 B、
B、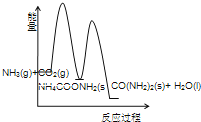
C、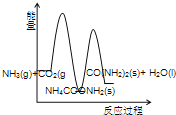 D、
D、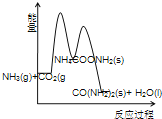
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
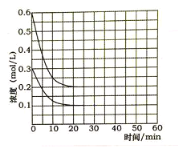
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
-
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) ⇌ CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) ⇌ NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) ⇌ CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、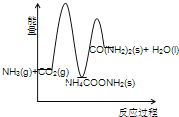 B、
B、
C、 D、
D、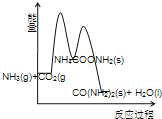
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
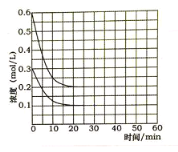
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
-
工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
(1)在密闭容器中充入NH3和CO2 ,一定条件能自发进行的原因是__________________
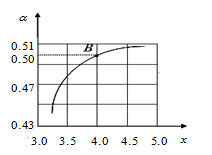
(2)T1℃ 时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是 ;
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是 ;
(3)当x=2,上述反应至5min时各物质的浓不再发生变化,若起始的压强为P0 KPa,测得平衡体系压强变为起始时的 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。
试计算该反应的平均速率v(CO2)= ,
该反应的平衡常数(K)=____ _,
达到平衡后NH3的物质的量浓度为 ,
CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:

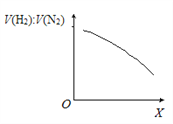







 B、
B、
 D、
D、

 B、
B、
 D、
D、

