-
半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
(1)步骤ⅰ,发生的是CO变换反应。
①CO变换反应的化学方程式是____________________________________。
②一定条件下,向体积固定为1 L的密闭容器中充入一定量半水煤气,发生CO变换反应。下图表示氢气与氮气的平衡体积比[V(H2):V(N2)]随外部条件X的变化关系。
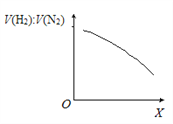
Ⅰ.X代表的物理量是______________________________。
Ⅱ.CO变换反应的△H _____0(填“>”或“<”),判断的依据是_____________________________。
③若用a、b、c、d 分别代表CO变换反应中相关化学键:H-H、H-O、 、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是
、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是 。消耗1mol CO时,该反应的热效应 △H = _______________。
。消耗1mol CO时,该反应的热效应 △H = _______________。
(2)步骤ⅱ中,用2.0 mol/L Na2CO3溶液作吸收剂脱除CO2。
①当溶液pH降至10的过程中(无沉淀析出),溶液中离子浓度关系正确的是________(选填字母)。
a.c(CO32-)+c(HCO3-) + c(H2CO3) =2.0 mol/L
b.c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)
c.c(Na+)>c(CO32-)>c(HCO3-)
②当脱除液失效时,请设计一种可使其再生的方法(结合化学方程式说明):___________________________。
-
半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。

(1)步骤I,CO变换反应的能量变化如下图所示:
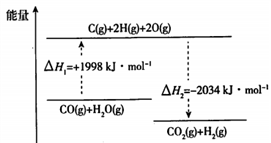
①CO变换反应的热化学方程式是________________。
②一定条件下,向体积固定的密闭容器中充入aL半水煤气,发生CO变换反应。测得不同温度(T1,T2)氢气的体积分数ψ(H2)与时间的关系如下所示。
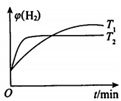
i.T1、T2的大小关系及判断理由是______________。
ii.请在上图中画出:其他条件相同时,起始充入0.5aL半水煤气,T2温度下氢气的体积分数ψ( H2)随时间的变化曲线。______________
(2)步骤Ⅱ,用饱和Na2CO3溶液作吸收剂脱除CO2时,初期无明显现象,后期有固体析出。
①溶液中离子浓度关系正确的是__________(选填字母)。
a.吸收前:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.吸收初期:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)=c(Na+)
c.吸收全进程:c(Na+)+c( H+)=2c(CO32-)+ c(HCO3-)+ c(OH-)
②后期析出固体的成分及析出固体的原因是___________。
③当吸收剂失效时,请写出一种可使其再生的方法(用化学方程式表示):____________。
-
半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O (g)。半水煤气经过下列步骤转化为 合成氨的原料。完成下列填空:
合成氨的原料。完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入 溶液中(填写试剂名称),出现 ,可以证明有硫化氢存在。
(2)写出半水煤气在铜催化下实现CO变换的反应方程式 ;若半水煤气中V(H2): V(CO): V(N2)=9:7:4,经CO变换后的气体中: V(H2): V(N2)=__________。
V(H2): V(N2)=__________。
(3)碱液吸收法是脱除二氧化碳的方法之一。有一吸收了二氧化碳的氢氧化钠洛液,为测定其溶液组成,采用双指示剂法进行滴定。
步骤:用移液管量取V0mL的该溶液于锥形瓶中,先滴入1-2滴酚酞做指示剂,滴定达到终点时用去c mol.L-1的标准盐酸溶液VlmL,此时再向溶液中滴入1-2滴__________做指示剂,达到滴定终点时又用去V2mL标准盐酸溶液。
第二次滴定达到终点时的现象是______________________。
数据处理:通过Vl和V2的相对大小可以定性也可定量判断溶液的组成。
若V1>V2,写出此时的溶质的化学式_______________。
若2V1=V2,写出此时溶液中离子浓度由大到小的顺序_________________。
讨论:若V1<V2,在第一次滴定时未用标准盐酸润洗酸式滴定管,第二次滴定前发现并纠正了错误,则____________(填化学式)浓度偏大。
-
半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
| Na2CO3 | K2CO3 |
| 20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
| 碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
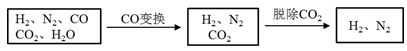
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
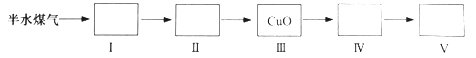
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤Ⅰ、Ⅱ的目的是:_________________。
③该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
-
半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
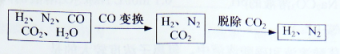
完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
| Na2CO3 | K2CO3 |
| 20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
| 碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
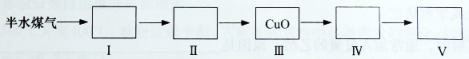
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
-
半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O (g)。半水煤气经过下列步骤转化为合成氨的原料。完成下列填空:

(1)半水煤气含有少量硫化氢。将半水煤气样品通入____________溶液中(填写试剂名称),出现___________,可以证明有硫化氢存在。
(2)写出半水煤气在铜催化下实现CO变换的反应方程式______________________;若半水煤气中V(H2): V(CO): V(N2)=9:7:4,经CO变换后的气体中:V(H2): V(N2)=__________。
(3)碱液吸收法是脱除二氧化碳的方法之一。有一吸收了二氧化碳的氢氧化钠洛液,为测定其溶液组成,采用双指示剂法进行滴定。
步骤:用移液管量取V0mL的该溶液于锥形瓶中,先滴入1-2滴酚酞做指示剂,滴定达到终点时用去c mol.L-1的标准盐酸溶液VlmL,此时再向溶液中滴入1-2滴__________做指示剂,达到滴定终点时又用去V2mL标准盐酸溶液。
第二次滴定达到终点时的现象是__________________________。
数据处理:通过Vl和V2的相对大小可以定性也可定量判断溶液的组成。
若V1>V2,写出此时的溶质的化学式_______________。
若2V1=V2,写出此时溶液中离子浓度由大到小的顺序_________________。
讨论:若V1<V2,在第一次滴定时未用标准盐酸润洗酸式滴定管,第二次滴定前发现并纠正了错误,则_________ (填化学式)浓度偏大。
-
半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O (g)。半水煤气经过下列步骤转化为合成氨的原料。完成下列填空:
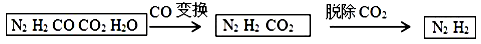
(1)半水煤气含有少量硫化氢。将半水煤气样品通入_____________________溶液中(填写试剂名称),出现_______________,可以证明有硫化氢存在。
(2)写出半水煤气在铜催化下实现CO变换的反应方程式_____________________;若半水煤气中V(H2): V(CO): V(N2)=9:7:4,经CO变换后的气体中:V(H2): V(N2)=___。
(3)碱液吸收法是脱除二氧化碳的方法之一。有一吸收了二氧化碳的氢氧化钠溶液,为测定其溶液组成,采用双指示剂法进行滴定。
步骤:用移液管量取V0 mL的该溶液于锥形瓶中,先滴入1-2滴酚酞做指示剂,滴定达到终点时用去c mol•L-1的标准盐酸溶液Vl mL,此时再向溶液中滴入1-2滴_____做指示剂,达到滴定终点时又用去V2 mL标准盐酸溶液。
第二次滴定达到终点时的现象是_______________________________。
数据处理:通过Vl和V2的相对大小可以定性也可定量判断溶液的组成。
若V1>V2,写出此时的溶质的化学式_______________。
若2V1=V2,写出此时溶液中离子浓度由大到小的顺序_________________。
讨论:若V1<V2,在第一次滴定时未用标准盐酸润洗酸式滴定管,第二次滴定前发现并纠正了错误,则_______________(填化学式)浓度偏大。
-
合成氨需要的原料气氢气主要来自水煤气,水煤气的主要成分:CO、H2、CO2,其中一种制取方法是用炽热的炭和水蒸气反应制得。
C(s)+H2O(g) CO(g)+H2(g) △H=+131.3kJ/mol
CO(g)+H2(g) △H=+131.3kJ/mol
(1)该反应的K值表达式为 。
(2)体积不变的条件下,下列措施中有利于提高CO产率的是 (填字母)。
A.升高温度 B.降低压强 C.增加C用量 D.通入H2
(3)某温度下,四种容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格①和②。
| 容器编号 | c(H2O)/mol/L | c(CO)/mol/L | c(H2)/mol/L | V正、V逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ① |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ② | V正=V逆 |
(4)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和1.0mol水蒸气(H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25倍。平衡时水蒸气的转化率为 ;向该容器中补充amol炭,水蒸气的转化率将(填“增大”、“减小”、“不变”),再补充amol水蒸气(H218O),最终容器中C16O和C18O的物质的量之比为 。
(5)已知:①C(s)+ O2(g)=CO(g);△H=-110.5kJ/mol
O2(g)=CO(g);△H=-110.5kJ/mol
②CO(g)+ O2(g)=CO2(g);△H=-283.0kJ/mol
O2(g)=CO2(g);△H=-283.0kJ/mol
③H2(g)+ O2(g)=H2O(g);△H=-241.8kJ/mol
O2(g)=H2O(g);△H=-241.8kJ/mol
那么,将2.4g炭完全转化为水蒸气,然后再燃烧,整个过程△H= kJ/mol。
-
以氢气、一氧化碳为主要成分,供化学合成的一种原料气体叫合成气。工业上通过“天然气蒸气转化”反应来得到合成气,其反应为:CH4+H2O(g) CO+3H2;△H>0。工业上通过采用合适的温度和压强、适宜的催化剂以及合适的CH4与H2O配比来获得最佳的生产效率。对于该转化反应的有关叙述正确的是( )
CO+3H2;△H>0。工业上通过采用合适的温度和压强、适宜的催化剂以及合适的CH4与H2O配比来获得最佳的生产效率。对于该转化反应的有关叙述正确的是( )
A.增大压强,有利于得到更多的合成气
B.反应温度越低,越有利于合成气的生产
C.工业生产中采用加入过量水蒸气来提高甲烷的利用率
D.工业生产中使用催化剂的目的在于提高甲烷的利用率
-
Ⅰ以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工业.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g) CO(g)+H2(g)△H=+131.3kJ•mol-1,
CO(g)+H2(g)△H=+131.3kJ•mol-1,
该反应在常温下________自发进行(填“能”与“不能”);在一体积为2L的密闭容器中,加入1molC和2mol H2O(g),达平衡时H2O的转化率为20%,请计算此时的平衡常数________
(2)目前工业上有一种方法是用CO与H2反应来生产甲醇.
| 化学键 | C-O | C-H | H-H | C≡O | O-H |
| 键能 kg/mol-1 | 358 | 413 | 436 | 1072 | 463 |
已知生成气态甲醇,CO里面含C≡O.请写出该反应的热化学方程式为________
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol
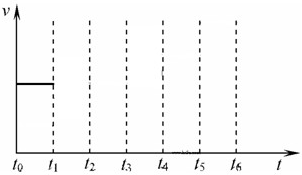
在一体积不变的容器中,当合成氨反应达到平衡后,在t1时升高温度,t2重新达到平衡,t3时充入氮气,t4时重新达到平衡,t5时移去一部分产物,t6时又达到平衡,请在下面的反应速率与时间关系图中画出t1到t5逆反应速率、t5到t6正反应速率的变化情况.
(4)氢气可用于生产燃料电池,丙烷气体也可以.美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-.则通丙烷的电极发生的电极反应为________
Ⅱ沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-=[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为________.
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:________.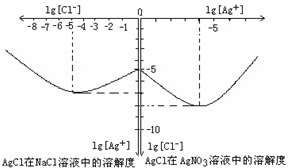

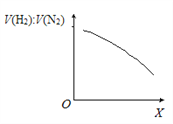
、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是
。消耗1mol CO时,该反应的热效应 △H = _______________。