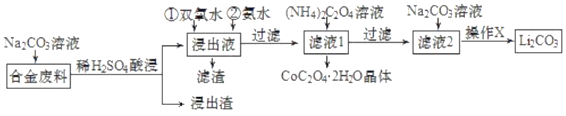
-
化学在保证人类的生存并不断提高人类的生活质量方面起着重要作用,它与科学技术、社会、环境密切相关。下列有关说法错误的是( )
A.绿色化学的核心是从源头上减少和消除工业生产对环境的污染
B.肼、氨、甲醇等燃料电池的热值远高于其直接燃烧的热值
C.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
难度: 简单查看答案及解析
-
一定条件下,在水溶液中1molCl-、ClOx-(x=1、2、3、4)的能量(kJ)相对大小如图所示。下列说法正确的是( )
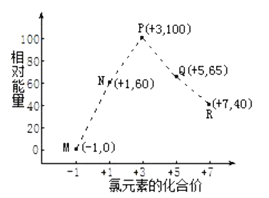
A.P点对应的微粒最稳定
B.R点微粒氧化性最强
C.由N点到M点的焓变为60kJ·mol-1
D.P点微粒发生歧化反应转化为N点和Q点微粒属于自发过程
难度: 中等查看答案及解析
-
新型光催化剂Zn2GeO4具有较高的催化活性。下列有关其组成元素的说法正确的是( )
A.Zn处于元素周期表中的d区
B.Ge的价电子排布式为3d104s24p2
C.基态O原子中成对电子数是未成对电子数的2倍
D.三种元素电负性由大到小的顺序是:O>Ge>Zn
难度: 简单查看答案及解析
-
下列离子方程式书写错误的是( )
A.工业上用FeS除去废水中的Hg2+:FeS+Hg2+=HgS+Fe2+
B.泡沫灭火器工作原理:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C.二氧化硫使酸性高锰酸钾溶液褪色:3SO2+2MnO4-+4H+=3SO42-+2Mn2++2H2O
D.NaClO溶液中通入少量二氧化碳:ClO-+CO2+H2O=HClO+HCO3-
[已知电离常数:K(HClO)=3×10-8;K(H2CO3)=4.31×10-7,K(HCO3-)=5.61×10-11]
难度: 简单查看答案及解析
-
在0.5L某刚性密闭容器中,充入2molCO和1molNO2,在一定条件下发生反应:4CO(g)+2NO2(g)
4CO2(g)+N2(g)。2min时该反应达到平衡,反应前后容器内压强比为12:11。下列判断错误的是( )
A.N2的平衡浓度为0.5mol·L-1
B.2min内NO2的平均反应速率为0.25mol·L-1·min-1
C.反应任意时刻CO和NO2的转化率均相等
D.平衡后再向容器中充入2molCO和1molNO2,再次平衡后,CO的转化率大于50%
难度: 中等查看答案及解析
-
下列实验中,有关操作、现象及结论均正确的是( )
选项
实验操作
实验现象
结论
A
将盛有NH4Cl和消石灰的小烧杯放在表面有水的玻璃片上,用玻璃棒搅拌小烧杯中的药品
片刻后,玻璃片表面的水结冰,将玻璃片和小烧杯粘在一起
NH4Cl和消石灰的反应属于吸热反应
B
将铁钉与电源正极相连,铜片与电源负极相连,把铁钉和铜片放入硫酸铜溶液中,接通直流电源
片刻后,铁钉表面附着一层红色固体
铁钉表面镀上一层铜
C
将NO2—N2O4平衡球的两端分别浸在盛有热水和冰水的烧杯中
球中气体颜色:热水中变浅,冰水中变深
升温使平衡向吸热方向移动
D
将盛有FeCl3饱和溶液的小烧杯用酒精灯加热一段时间
小烧杯中液体由棕黄色变为红褐色
有氢氧化铁胶体生成
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
南京大学研究发现TiO2-x晶体中存在的晶体缺陷有利于提高导电性和提供镁离子储位,可用作新型镁电池负极材料,该电池的工作原理如图所示。下列说法正确的是( )
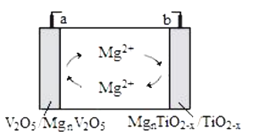
A.放电时,a电极电势低于b电极
B.充电时,Mg2+向a电极移动
C.放电时,负极的电极反应为MgnTiO2-x-2ne-=nMg2++TiO2-x
D.充电时,当有0.2mole-转移时,b电极的质量减少2.4g
难度: 简单查看答案及解析
-
NH4Al(SO4)2在分析试剂、医药、电子工业中用途广泛。下列有关说法正确的是( )
A.NH4Al(SO4)2属于弱电解质,其溶液导电性较弱
B.NH4Al(SO4)2溶液中NH4+水解产生的NH3·H2O促进Al3+水解
C.0.1mol·L-1NH4Al(SO4)2中离子浓度大小顺序为c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-)
D.常温下,0.1mol·L-1NH4Al(SO4)2中滴加氨水至中性时,c(NH4+)=2c(SO42-)
难度: 简单查看答案及解析
-
H2或CO可以催化还原NO以达到消除污染的目的。已知一定温度下
①N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
下列有关说法错误的是( )
A.H2催化还原NO生成氮气和液态水的热化学方程式为:2H2(g)+2NO(g)=N2(g)+2H2O(l) ΔH=-752.1kJ·mol-1
B.汽车排气筒内安装尾气催化转化器可大大降低氮氧化物的排放
C.硝酸厂产生的尾气只要通入一定量氢气即可达到排放标准
D.CO催化还原NO生成无污染的气体33.6L(标准状况),放出热量为373.25kJ
难度: 简单查看答案及解析
-
两种不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示。p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)。已知硫酸钡在水中溶解吸收热量。下列说法正确的是( )
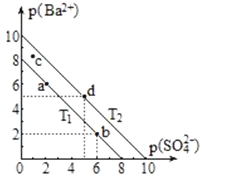
A.温度高低:T1<T2
B.加入BaCl2固体,可使溶液由a点变到b点
C.c点对应的溶液在T1温度时有固体析出
D.T2温度下,BaSO4的Ksp=1×10-25mol2·L-2
难度: 简单查看答案及解析
-
顺—1,2—二甲基环丙烷和反—1,2—二甲基环丙烷可发生如下转化:
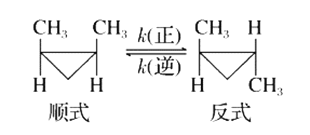
该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)分别称作正、逆反应速率常数,它们受温度和催化剂影响。下列有关说法正确的是( )
A.某温度时,该反应的平衡常数可表示为K=
B.正、逆反应速率常数改变,平衡常数也一定会随之改变
C.若升高温度,平衡逆向移动,则说明正反应的活化能高于逆反应的活化能
D.催化剂可以改变反应速率但不影响平衡,说明催化剂同等程度改变k(正)和k(逆)
难度: 中等查看答案及解析
-
KH2PO4在农业上用作高效磷钾复合肥,在化学工业中还用作制偏磷酸钾的原料。一种电解法制备KH2PO4的装置如图所示。下列说法错误的是( )
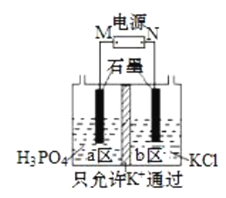
A.电源M极为负极,a区生成KH2PO4
B.b区电极反应为:4OH--4e-=O2↑+2H2O
C.电解过程中a区水的电离平衡正向移动
D.当0.1molK+通过离子交换膜时,阴阳两极产生的气体共2.24L(标准状况)
难度: 简单查看答案及解析