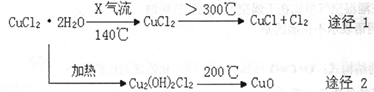-
焦亚硫酸钠(Na2S2O5)在食品加工、印染、印刷、制革以及有机合成等工业中应用广泛。实验室模拟工业湿法制备焦亚硫酸钠装置如图所示。
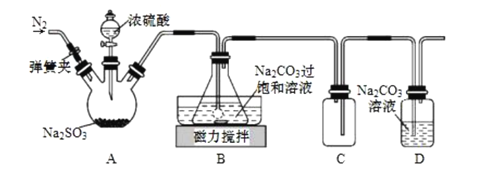
打开弹簧夹,通入一段时间N2后关闭弹簧夹,加入一定量浓硫酸;不断搅拌,控制反应温度在40℃左右,当溶液pH约为4.1时,停止反应,降温至20℃左右静置结晶。
已知:
①温度在40℃左右时,发生反应2NaHSO3=Na2S2O5+H2O。
②温度过高时焦亚硫酸钠分【解析】
Na2S2O5=Na2SO3+SO2↑。
③焦亚硫酸钠与水易发生反应:Na2S2O5+H2O=2NaHSO3。
回答下列问题:
(1)A装置中所加硫酸通常为1:1(体积比)的浓硫酸,一般不采用90%以上的浓硫酸,原因是__。
(2)B装置中控制反应温度40℃在左右的方法是__;锥形瓶中生成NaHSO3的离子方程式为__。
(3)装置C的作用是__。
(4)锥形瓶中析出固体经减压抽滤、洗涤、晾干,可获产品。洗涤操作中依次用饱和SO2水溶液、无水乙醇洗涤,其作用是__。
(5)反应结束后,需要再次打开弹簧夹,通入一段时间N2,目的是__。
(6)某同学认为Na2S2O5属于强碱弱酸盐,在溶液中水解显碱性。实际他测得Na2S2O5溶液显酸性,请用数据帮他分析溶液显酸性的原因__。
(已知:常温下H2SO3电离常数Ka1=1.54×10-2,Ka2=1.02×10-7)
-
(15分)实验题:
次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验装置如下图所示:
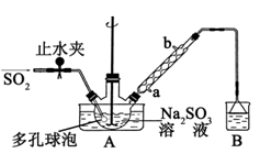
实验步骤:
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液;
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是_______________________;冷凝管中冷却水从__________(填“a”或“b”)口进水。
(2)A中多孔球泡的作用是____________________________________________________;
(3)写出步骤2中发生反应的化学方程式________________________________________;
(4)步骤3中在真空容器中蒸发浓缩的原因是是防止温度过高使产物分解,也防止_____________;
(5) 为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g。M(NaHSO2·HCHO·2H2O)=154g/mol]
①如何检验沉淀是否洗净_____________________________________________________;
②则所制得的产品的纯度为______________________。
-
次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、 医药以及原子能工业中有广泛应用。以 Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的 实验装置如下图所示:

实验步骤:
步骤 1:在三颈烧瓶中加入一定量 Na2SO3 和水,搅拌溶解,
缓慢通入 SO2,至溶液 pH 约为 4,制得 NaHSO3 溶液;
步骤 2:将装置 A 中导气管换成橡皮塞。向烧瓶中加入稍过量 的锌粉和一定量甲醛溶液,在 80~90℃下,反应约 3h,冷却 至室温,抽滤;
步骤 3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置 B 的烧杯中应加入的溶液是____________;冷凝管中冷却水从____________(填“a”或“b”)口进 水。
(2)A 中多孔球泡的作用是____________。
(3)写出步骤 2 中发生反应的化学方程式____________。
(4)步骤 3 中在真空容器中蒸发浓缩的原因是是防止温度过高使产物分解,也防止____________。
(5)为了测定产品的纯度,准确称取 2.0g 样品,完全溶于水配成 100mL 溶液,取 20.00mL 所配溶 液,加入过量碘完全反应后(已知 I2 不能氧化甲醛,杂质不反应),加入 BaCl2 溶液至沉淀完全,过 滤、洗涤、干燥至恒重得到白色固体 0.466g。M(NaHSO2·HCHO·2H2O)=154g/mol]
①如何检验沉淀是否洗净____________。
②则所制得的产品的纯度为____________。
-
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠 溶液 | 5.0 |
| B | 3 mL乙醇、2 mL乙酸 | 0.1 |
| C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 |
| D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是_____________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________(答出两条即可)。
-
(12分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:
请根据要求回答下列问题:
(1) 写出该反应的化学方程式________
(2)此反应中浓硫酸的作用是 ________
饱和碳酸钠的作用是________
(3)若采用同位素示踪法研究该化学反应,反应物无水乙醇中含有18O,冰醋酸中均为16O,反应后的混合物中,含有18O的物质有________
(4)若用如图所示装置来制备少量的乙酸乙酯,锥形瓶中的现象为________,不过往往产率偏低,其原因可能为(任填2种)
-
氯化亚铜(CuCl)是白色粉末,微溶于水,能与稀硫酸反应,广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuC12•2H2O制备CuCl,并进行相关探究(已知酸性条件下Cu+不稳定)。
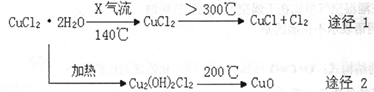
下列说法正确的是
A. X气体可以是N2,目的是做保护气,抑制CuCl2•2H2O加热过程可能的水解
B. CuCl与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
C. 途径1中产生的Cl2可以回收循环利用,也可以通入饱和CaCl2溶液中除去
D. 途径2中200℃下反应的化学方程式为:Cu2(OH)2Cl2 2CuO + 2HCl
2CuO + 2HCl
-
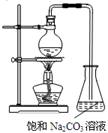
硫的化合物种类较多,用途广泛。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,其制备的反应原理为:Na2SO3+ SO2==Na2S2O5
某研究小组利用下图装置制取Na2S2O5,盛硫酸的仪器叫分液漏斗。

(1)写出装置甲中发生反应的化学方程式__________________。
(2)关闭K3,要求只检查装置甲的气密性,请至少写出两种不同的操作方法。
方法1:_________________________。
方法2:_________________________。
方法3:_________________________。
(3)装置乙的作用是________________。
(4)写出焦亚硫酸钠晶体在空气中被完全氧化的化学方程式_____________。
II:硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3 、FeCl2、CuCl2的混合溶液中反应用以回收S,其物质转化如图所示。
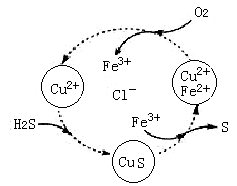
(1)反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为 _____________。
(2)在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施是___________________。
(3)写出图中各步转化的化学方程式:____________________。
-
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
 CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)若用右图所示装置来制备少量的乙酸乙酯,其中饱和碳酸钠溶液的作用是______.
(2)此反应以浓硫酸为催化剂,可能会造成______、______等问题.
(3)在图所示的装置中进行50mL 0.50mol/L醋酸与50mL 0.55mol/L NaOH溶液的中和反应.通过测定反应过程中所放出的热量可计算反应热.回答下列问题: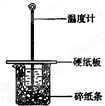
①从实验装置上看,图中尚缺少的一种玻璃用品是______;
②在题述反应条件下,测得反应前醋酸和NaOH溶液的温度均为25.43℃,反应后混合溶液的温度为28.73℃.已知反应前醋酸
和NaOH溶液的密度均为1.0g•cm-3,反应后混合溶液的比热容为c=4.18J/.试写出中和反应的热化学方程式:______.
-
七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 | | | | |
| | | | | | | | | | | |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 | | | | | | | |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / | | | | | |
| | | | | | | | | | | | | | | | | |
硼镁泥制取七水硫酸镁的工艺流程如下:
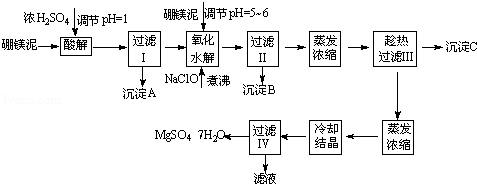
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 。
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 。
-
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:
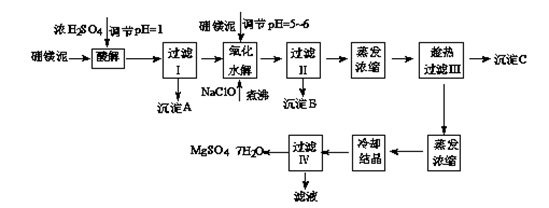
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为________。加热煮沸的主要目的是________。
(2)沉淀B中除MnO2、SiO2外还含有________(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是________;
(4)沉淀C的化学式是________。过滤III需趁热过滤的理由是________