-
下列说法错误的是
A. 《己亥杂诗》中“落红不是无情物,化作春泥更护花”蕴藏着自然界碳、氮的循环
B. 《周礼》中“煤饼烧蛎房成灰”(蛎房即牡蛎壳),“灰”的主要成分为CaCO3
C. 《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露……”。这种方法是蒸馏
D. 《天工开物》中“凡研硝(KNO3)不以铁碾入石臼,相激火生”,相激火生是指爆炸
难度: 简单查看答案及解析
-
下列实验对应的实验现象和结论或解释都正确的是( )
选项
实验操作
实验现象
结论或解释
A
KI淀粉溶液中通入少Cl2
溶液变蓝
Cl2能与淀粉发生显色反应
B
向稀溴水中加入苯,充分振荡、静置
水层几乎无色
苯与溴水发生了取代反应
C
向蔗糖溶液中加入几滴稀硫酸,水浴加热,然后加入银氨溶液,加热
无银镜出现
不能判断蔗糖是否水解
D
向FeCl3和AlCl3混合溶液中滴加过量NaOH溶液
出现红褐色沉淀
Ksp[Fe(OH)3]<Ksp[Al(OH)3]
A.A B.B. C.C D.D
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A.中子数为8的氧原子:
O
B.氯离子的结构示意图:
C.Na2S的电子式:
D.2–丙醇的结构简式:(CH3)2CHOH
难度: 中等查看答案及解析
-
实验是研究化学的基础,下列图中所示的实验操作中正确的是( )
A.干燥SO2
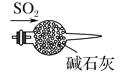 B.实验室制取并收集氧气
B.实验室制取并收集氧气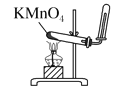 C.装置气密性的检查
C.装置气密性的检查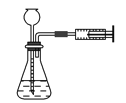 D.吸收氨气
D.吸收氨气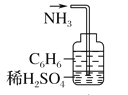
难度: 困难查看答案及解析
-
下列离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl
Mn2++2Cl-+Cl2↑+2H2O
B.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O
C.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O
D.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.糖类化合物都具有相同的官能团
B.将海产品用甲醛溶液浸泡以延长保鲜时间
C.油脂和氨基酸在一定条件下均可以与氢氧化钠溶液反应
D.通过石油分馏获得乙烯,已成为目前工业上生产乙烯的主要途径
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14g由C2H4和N2组成的混合气体中所含质子总数一定为7.5NA
B.1molP4S3(
)中所含P—S键的数目为9NA
C.1L0.1mol·L-1NaHSO3溶液中所含阳离子的总数大于0.1NA
D.11.2LCl2与足量乙烷在光照条件下反应产生HCl分子的总数为0.5NA
难度: 简单查看答案及解析
-
分子式为C7H7Cl,且分子中含有苯环的同分异构体有(不考虑立体结构)
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
短周期主族元素 W、X、Y、Z位于三个不同的周期,W与Y同主族,X 与 Z 的核外电子数之和是Y的核外电子数的2倍。化合物甲的结构式如图所示,甲不溶于水。下列说法正确的是( )
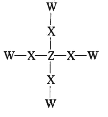
A.简单离子半径:Y>X
B.非金属性:Z>X
C.化合物甲中每个原子都达到了8电子稳定结构
D.由 W、X、Y 三种元素形成的化合物的水溶液能与 Z 的单质反应
难度: 中等查看答案及解析
-
电化学在日常生活中用途广泛,如图是镁次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列说法不正确的是( )
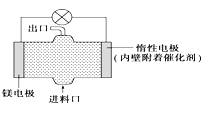
A.镁电极是该电池的负极 B.惰性电极上发生氧化反应
C.正极反应式为ClO-+H2O+2e-═Cl-+2OH- D.进料口加入NaClO溶液,出口为NaCl溶液
难度: 中等查看答案及解析
-
用下列两种途径制取H2SO4,某些反应条件和产物已省略,下列有关说法不正确的是( )
途径① S
H2SO4,途径② S
SO2
SO3
H2SO4
A.途径①反应中体现了浓硝酸的强氧化性和酸性
B.途径②的第二步反应在实际生产中可以通过增大O2的浓度来降低成本
C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol电子
D.途径②与途径①相比更能体现“绿色化学”的理念
难度: 中等查看答案及解析
-
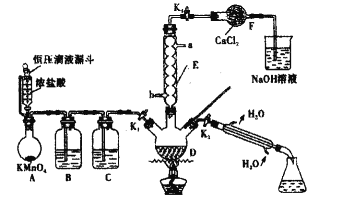
利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3•6H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl3•6H2O。下列实验原理和装置不能达到实验目的的是( )
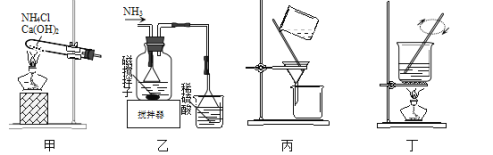
A.用装置甲制备NH3 B.用装置乙制备Cu(NH3)4Cl2并沉铁
C.用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3 D.用装置丁将FeCl3溶液蒸干制备FeCl3•6H2O
难度: 中等查看答案及解析
-
洗发水是否合格,需要检测二噁烷
含量。关于该有机物的说法中正确的是( )
A. 一氯代物有4种 B. 与
互为同系物
C. 所含官能团为醚键 D. 所有原子均处于同一平面
难度: 中等查看答案及解析
-
下列各组物质相互混合反应后,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中 ④Na2O2投入FeCl2溶液中.
A.只有①④ B.只有③ C.只有②③ D.只有①③④
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X和W同主族且W的单质是重要的半导体材料,Y原子的最外层电子数是其内层电子数的3倍,Z2+与Y2-核外电子排布相同。下列说法正确的是
A.X的氢化物中仅含有极性键
B.X与Y形成的三原子分子的电子式是
C.原子半径Z>Y,离子半径Z2+< Y2-
D.X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断
难度: 中等查看答案及解析
-
化合物 M(
)、N(
)、P(
)都是重要有机物的原料。下列有关 M、N、P 的说法不正确的是( )
A.M、N 互为同分异构体 B.P 中所有碳原子可能共平面
C.M、P 均能发生加成反应和取代反应 D.M 能使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
天然海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。火力发电时燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:下列说法错误的是( )

A.天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解
B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42-
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同
难度: 困难查看答案及解析
-
CO2经催化加氢可合成乙烯:2CO2(g)+6H2(g )
C2H4(g)+4H2O(g)。0.1Mpa时,按n(CO2):n(H2)=1:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图,下列叙述不正确的是( )
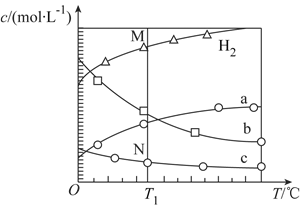
A.该反应的ΔH<0
B.曲线b代表H2O
C.N点和M点所处的状态c(H2)不一样
D.其它条件不变,T1℃、0.2MPa下反应达平衡时c(H2)比M点大
难度: 中等查看答案及解析
-
某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是
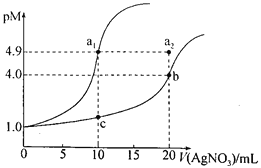
A.该温度下,Ksp(Ag2CrO4)=4×10-12
B.al、b、c三点所示溶液中c(Ag+):al>b>c
C.若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点
D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
难度: 困难查看答案及解析
-
电渗析法淡化海水装置示意图如下,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是( )
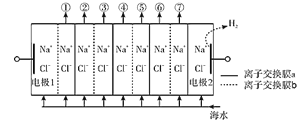
A.离子交换膜a为阴离子交换膜
B.通电时,电极2附近溶液的pH增大
C.淡化过程中,得到的浓缩海水没有任何使用价值
D.各间隔室的排出液中,②④⑥为淡水
难度: 中等查看答案及解析
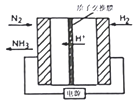

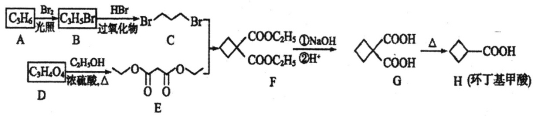
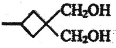 和化合物E为原料(无机试剂任选),设计制备
和化合物E为原料(无机试剂任选),设计制备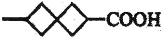 的合成路线________________________________。
的合成路线________________________________。