-
Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______(填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________。
② O3分子中心原子杂化类型为_______;O3是极性分子,理由是___________________。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________。
② 在方法Ⅱ的反应中,形成的化学键有_______(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。
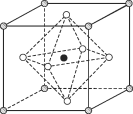
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________位置,两个Na之间的最短距离为________nm。
②用a、d表示阿伏加德罗常数的值NA=__________________(列计算式)。
-
Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______(填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________。
② O3分子中心原子杂化类型为_______;O3是极性分子,理由是___________________。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________。
② 在方法Ⅱ的反应中,形成的化学键有_______(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。
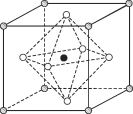
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________位置,两个Na之间的最短距离为________nm。
②用a、d表示阿伏加德罗常数的值NA=__________________(列计算式)。
-
Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______(填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________。
② O3分子中心原子杂化类型为_______;O3是极性分子,理由是___________________。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________。
② 在方法Ⅱ的反应中,形成的化学键有_______(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。

①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________位置,两个Na之间的最短距离为________nm。
②用a、d表示阿伏加德罗常数的值NA=__________________(列计算式)。
-
(5分)如图所示为高温超导领域里的一种化合物——钙钛矿 晶体结构,该结构是具有代表性的最小重复单位。
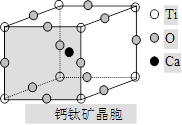
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有________、________个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是________。该物质的化学式可表示为________。
(3)若钙、钛、氧三元素的相对质量分别为a,b,c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为________g/cm3。
-
钙钛矿太阳能电池具有转化效率高、低成本等优点,是未来太阳能电池的研究方向。回答下列问题:
(1)下列状态的钙中,电离最外层一个电子所需能量最大的是__________(填字母标号)。
A.[Ar]4s1 B.[Ar]4s2 C.[Ar]4s14p1 D.[Ar]4p1
(2)基态钛原子的核外价电子轨道表达式为____________。
(3)一种有机金属卤化钙钛矿中含有NH2-CH=NH2+,该离子中氮原子的杂化类型为___________,其对应分子NH2-CH=NH的熔沸点高于CH3CH2CH=CH2的熔沸点的原因为__________。
(4)一种无机钙钛矿CaxTiyOz的晶体结构如图所示,则这种钙钛矿化学式为___________,已知Ca和O离子之间的最短距离为a pm,设阿伏加德罗常数的值为NA,则这种钙钛矿的密度是___________g·cm-3(列出计算表达式)。
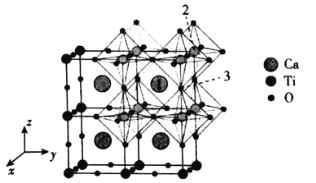
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为( ,
, ,
, ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
-
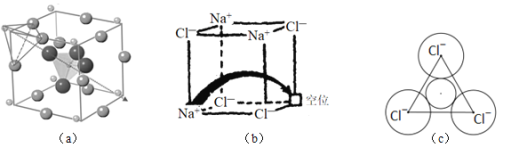
固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子 如
如 提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图
提供快速迁移的宽敞通道或者有“点缺陷”,都能使其具有导电潜力。比如:图 所示的锂超离子导体
所示的锂超离子导体 和图
和图 所示的有“点缺陷”的NaCl。
所示的有“点缺陷”的NaCl。
根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态Cl的________能级,此过程会_______ 填“吸收”或“释放”
填“吸收”或“释放” 能量。
能量。
(2) 中B的杂化形式为__________,其等电子体为:___________
中B的杂化形式为__________,其等电子体为:___________ 任写一种
任写一种 。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是____________。
。与其VSEPR模型相同,且有1对孤电子对的相对分子质量最小的分子是____________。
(3)图 所示晶胞中
所示晶胞中 位于__________位置;若将晶体中形成宽敞通道的
位于__________位置;若将晶体中形成宽敞通道的 换成
换成 ,导电能力会明显降低,原因是_____________。
,导电能力会明显降低,原因是_____________。
(4)图 中,若缺陷处填充了
中,若缺陷处填充了 ,则它____________
,则它____________ 填“是”或“不是”
填“是”或“不是” 的晶胞,在NaCl晶体中,
的晶胞,在NaCl晶体中, 填充在
填充在 堆积而成的___________面体空隙中。
堆积而成的___________面体空隙中。
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。请完成下列问题:
(1)M元素的简单离子的结构示意图为_______。
(2)Z在周期表中的位置为_____,其非金属性比W的非金属性____(填“强”或“弱”)。
(3)X、Z、W的原子半径由大到小顺序为_____________(填元素符号)。
(4)Y的氢化物化学式为______,该氢化物中化学键类型为________________(填“离子键”、“极性共价键”或“非极性共价键”)。
(5)W的单质与X的最高价氧化物的水化物反应的离子方程式为_____。
-
钙钛矿可以制成太阳能电池、发光二极管和催化剂,甚至可以制成未来量子计算机的元件。钙钛矿并不是专指某种含钙和钛的化合物,而是一类具有ABX3组成的晶体材料的总称,其中A和B是阳离子,X是阴离子。
(1)历史上所发现的第一种钙钛矿,是天然矿物钛酸钙(CaTiO3),其中Ti4 +的核外电子排布式为____;钛酸钙中两种阳离子中半径较大的是__。
(2)一种有机卤化铅钙钛矿是由[CH (NH2)2]+、Pb2+和Cl-构成的,这种钙钛矿的化学式为___,在[CH(NH2)2]+中碳原子的杂化方式为____。
(3)2018年我国科学家制得世界首例无金属钙钛矿材料。下列有机阳离子均可用于制备无金属钙钛矿:
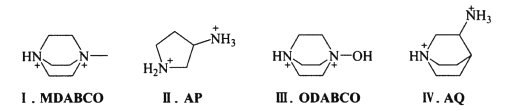
其中含有手性碳原子的是____(填序号)。
(4)如图是CaTiO3的两种晶胞结构示意图,两种晶胞的参数均为a=b=c=379. 5 pm,α=β=γ=90°;
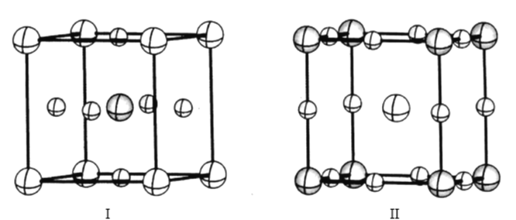
在晶胞I中氧离子占据的是___(填“体心”“面心”或“顶点”),在晶胞II中氧离子之间最近的距离是___pm(列出计算表达式)。
(5)无金属钙钛矿MDABCO—NH4 I3的晶胞类型与CaTiO3相同。若在MDABCO-NH4I3的晶胞中NH4+的分数坐标为( ,
, ,
, ),其中一种I-的分数坐标为(0,0,
),其中一种I-的分数坐标为(0,0, ),则MDABCO的分数坐标为___。与MDABCO 距离最近的I-的个数为____个。
),则MDABCO的分数坐标为___。与MDABCO 距离最近的I-的个数为____个。
-
 具有钙钛矿型结构,因具有优异的电极化特性、铁磁性、非磁绝缘性等而备受关注。回答下列问题:
具有钙钛矿型结构,因具有优异的电极化特性、铁磁性、非磁绝缘性等而备受关注。回答下列问题:
 下列F原子轨道表达式所表示的状态,能量由高到低的顺序正确的是_______
下列F原子轨道表达式所表示的状态,能量由高到低的顺序正确的是_______ 填选项字母
填选项字母 。
。

A.



 相同压强下,HF、HCl、HBr的沸点由高到低的顺序为_________,原因为_______。
相同压强下,HF、HCl、HBr的沸点由高到低的顺序为_________,原因为_______。
 元素可形成多种重要化合物,如
元素可形成多种重要化合物,如 、
、 、
、 等。其中
等。其中 的VSEPR模型为_____________;
的VSEPR模型为_____________; 中N原子的杂化形式为__________;
中N原子的杂化形式为__________; 中
中 键与
键与 键的数目之比为_________。
键的数目之比为_________。
 组成
组成 的原子的第一电离能由小到大的顺序为___________
的原子的第一电离能由小到大的顺序为___________ 用元素符号表示
用元素符号表示 ;其中三种原子基态时所含未成对电子数最多的是_________
;其中三种原子基态时所含未成对电子数最多的是_________ 填元素符号
填元素符号 。
。
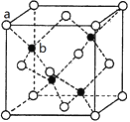
 的立方晶胞结构如图所示,其中
的立方晶胞结构如图所示,其中 采用简单立方堆积。
采用简单立方堆积。

 与
与 紧邻的F原子个数为__________。
紧邻的F原子个数为__________。
 若晶胞参数为
若晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体密度为_______
,则晶体密度为_______ 用含a、
用含a、 的代数式表示
的代数式表示 。
。
-
利用水热和有机溶剂等软化学方法,可合成出含有有机杂化锌、锗以及砷等金属的硒化物,且该硒化物具有离子交换、催化、吸附、半导体等性能,显示出良好的应用前景。回答下列问题:
(1)锌基态原子核外电子排布式为:___________________。
(2)元素锗与砷中,第一电离能较大的是:___________________(填元素符号)。
(3)SeO32-离子中Se原子的杂化形式为:_____________,气态SeO3分子的立体构型为:__________,与SeO3互为等电子体的一种离子为:_________________。(填离子符号)。
(4)硒化锌是一种重要的半导体材料,其晶胞结构如下图所示(a代表Zn,b代表Se),该晶胞中Se原子周围与之紧邻的其他Se原子数为:_______________________。
Na3OCl
2Na3OCl + H2↑










