-
国庆70周年阅兵庆典上,食品级彩烟在空中形成的气体彩带给人留下深刻的印象。靛蓝、玫瑰精、偶红、次甲蓝、槐黄、酞青蓝等都是常用的航空液体彩色拉烟剂,是因为它们( )
A.易被氧化 B.易被还原 C.易分解 D.易挥发
难度: 简单查看答案及解析
-
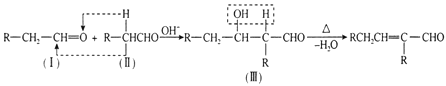
下列有关化学用语表示正确的是( )
A.氨基(-NH2)的电子式:
B.质子数为117,中子数为176的Ts原子:
Ts
C.对硝基苯酚的结构式:
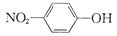
D.NaHCO3水解的离子方程式:HCO3-+H2O⇌H3O++CO32-
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A.SiO2硬度高,可用于制造光导纤维
B.Al(OH)3受热易分解,可用作胃酸中和剂
C.石墨具有导电性,可用作电极材料
D.Na2S具有还原性,可用于去除水体中的Hg2+
难度: 简单查看答案及解析
-
中学化学中常见的物质A、B、C、D、E均含同种短周期主族元素,其中A为单质,五种物质间的转化关系如图所示。下列说法错误的是( )
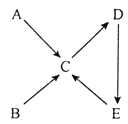
A.若B、C均为氧化物,则A可能为碳单质
B.若C、D均为氧化物,则A一定为非金属单质
C.若D为Na2CO3,则A一定为钠单质
D.若E为含氧强酸,则B与C可能反应生成A
难度: 困难查看答案及解析
-
制备并收集NH3过程中,下列装置能达到实验目的的是( )
A.制取NH3

B.干燥NH3
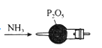
C.收集NH3
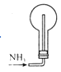
D.尾气处理
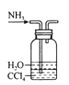
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.MnO2与浓盐酸混合加热:MnO2+4H++4C1-
MnCl2+C12↑+2H2O
B.向C6H5ONa溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
C.酸性条件下,用H2O2将Fe2+转化为Fe3+:H2O2+Fe2++2H+═Fe3++2H2O
D.将Cu片溶于稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O
难度: 中等查看答案及解析
-
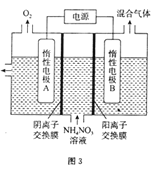
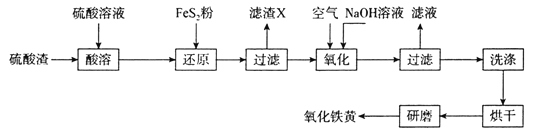
一种铜单质的生产流程如图所示,其中精黄铜矿粉为CuFeS2。下列说法正确的是( )
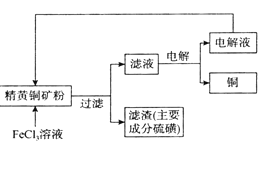
A.精黄铜矿粉发生的反应是CuFeS2+3Fe3++2H+=Cu2++4Fe2++2S
B.“滤渣”中的硫磺可以用酒精萃取出来
C.用石墨电极电解“滤液”,阳极最先发生的电极反应为4OH--4e-=2H2O+O2↑
D.该流程中可以循环利用的物质是FeC13
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是( )
A.1molN2与4molH2在一定条件下充分反应,转移电子数目为6NA
B.9.2g14CO2与N218O的混合物中所含中子数目为4.8NA
C.标准状况下,22.4L己烷中所含共价键数目为19NA
D.100mL0.1mol•L-1草酸溶液所含氢离子数目为0.02NA
难度: 中等查看答案及解析
-
2019年诺贝尔化学奖由M.Stanley Whittingham、JohnB.Goodenough和吉野彰三位科学家分享,以表彰他们在锂电池发展上做出的杰出贡献。以石墨烯和金属锂为电极的锂-空气电池原理如图所示。下面关于该电池的说法错误的是( )
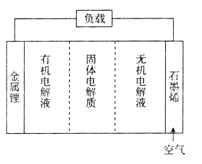
A.锂电极的电极反应式:Li-e-=Li+
B.空气中的O2在石墨烯电极上发生还原反应
C.电池工作时电流从锂电极沿导线流向石墨烯电极
D.电池工作时锂离子向石墨烯电极方向移动
难度: 中等查看答案及解析
-
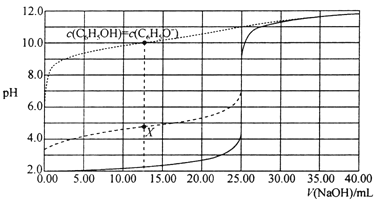
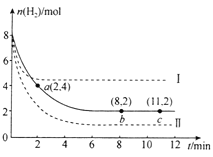
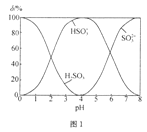
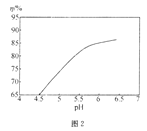
关于下列图示的阐释正确的是( )
A.
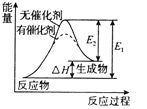 表示某一放热的基元反应在有无催化剂的情况下反应过程中的能量变化
表示某一放热的基元反应在有无催化剂的情况下反应过程中的能量变化B.
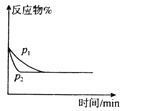 表示不同压强对可逆反应C(s)+H2O(g)
表示不同压强对可逆反应C(s)+H2O(g)CO(g)+H2(g)的影响
C.
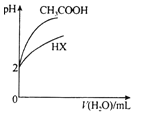 表示25℃时,体积均为100mL、pH=2的CH3COOH溶液和HX溶液加水稀释过程中pH的变化,则25℃时的电离常数:HX>CH3COOH
表示25℃时,体积均为100mL、pH=2的CH3COOH溶液和HX溶液加水稀释过程中pH的变化,则25℃时的电离常数:HX>CH3COOHD.
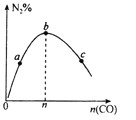 表示反应2CO(g)+2NO(g)
表示反应2CO(g)+2NO(g)N2(g)+2CO2(g),在其他条件不变时,改变起始时CO的物质的量,平衡时N2的体积分数变化,则NO的转化率:c>b>a
难度: 中等查看答案及解析
-
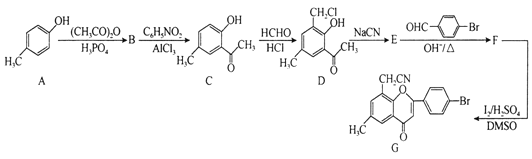
有机化合物甲、乙、丙均为合成非甾体抗炎药洛那的底物或中间体。下列关于甲、乙、丙的说法正确的是( )
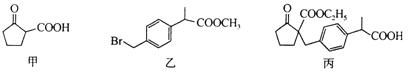
A.甲分子中所有碳原子处于同一平面
B.乙在一定条件下可以发生消去反应
C.1mol丙与足量NaOH溶液反应,最多消耗3molNaOH
D.一定条件下,甲、乙、丙均能与H2发生加成反应
难度: 中等查看答案及解析
-
Burns和Dainton研究发现C12与CO合成COCl2的反应机理如下:
①C12(g)
2C1•(g)快
②CO(g)+C1•(g)
COC1•(g)快
③COC1•(g)+C12(g)
COC12(g)+C1•(g)慢
其中反应②存在v正=k正[CO][C1•]、v逆=k逆[COC1•]
下列说法正确的是( )
A.反应①的活化能大于反应③的
B.反应②的平衡常数K=
C.要提高合成COCl2的速率,关键是提高反应②的速率
D.选择合适的催化剂能加快该反应的速率,并提高COC12的平衡产率
难度: 中等查看答案及解析