-
H2O2俗名双氧水,广泛应用于医药、国防、工业、农业、化工等领域中。H2O2易分解,需加入一定量的尿素、乙酰苯胺等有机物作为稳定剂。测定H2O2含量的常用方法有碘量法、高锰酸钾法、硫酸铈法等。回答下列问题:
(1)碘量法是将过量的KI溶液加入H2O2样品中,然后加入指示剂,用0.10mol•L-1Na2S2O3标准溶液滴定(发生反应:I2+2S2O32-=S4O62-+2I-)。滴定时所用指示剂为___;若某次滴定过程中消耗标准溶液12.50mL,则该过程中转移的电子为__mol。
(2)高锰酸钾法是用酸性KMnO4溶液滴定H2O2样品以测定其含量,写出反应的离子方程式:___;高锰酸钾法虽操作简单,但测定误差较大。某科研工作者对大量测定结果进行分析,发现94%的结果超过实际含量,主要原因是__(不考虑KMnO4的分解及实验操作误差)。
(3)硫酸铈法测定H2O2的含量:取H2O2样品1.00mL,稀释为250.00mL,取上述稀释过的H2O2溶液25.00mL于锥形瓶中,加入适量稀硫酸和2~3滴Fe2+-邻菲罗啉混合指示剂,摇匀后,用0.08mol•L-1Ce(SO4)2标准溶液滴定至终点(到达终点时Ce元素显+3价)。重复测定2~3次,平均消耗标准溶液22.08mL,则该H2O2样品的质量浓度为___g•L-1(结果保留1位小数);若未用Ce(SO4)2标准溶液润洗滴定管,会造成测定结果___(填“偏高”或“偏低”)。
高三化学实验题中等难度题查看答案及解析
-
过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素:反应的方程式为:
CO(NH2)2+H2O2
CO(NH)2·H2O2。过氧化尿素的部分性质如下:

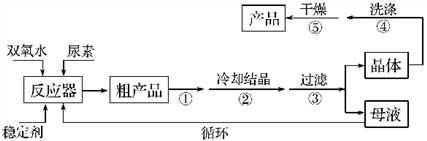
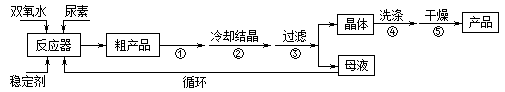
合成过氧化尿素的流程及反应装置图如下:
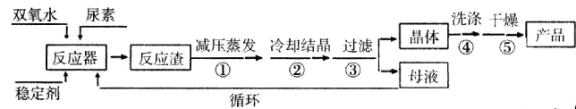
请回答下列问题:
(1)仪器X的名称是____________;冷凝管中冷却水从____________(填“a”或“b”)口进入。
(2)反应器的加热方式是_______________。
(3)搅拌器是否可用铁质材料___________(填“是”或“否”),原因是_______________。
(4)步骤① 采用减压蒸发的原因是___________。
(5)下列选项中,最适合作为步骤④ 的洗涤液是_______。
a.冰水 b.热水 c.饱和NaCl溶液 d.酒精和水的混合液
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol/L H2SO4,用0.1000 mol/L KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应)。
① 滴定终点的现象是______________。
② 则产品中CO(NH)2·H2O2的质量分数为______________。
③ 若滴定前仰视,滴定后俯视,则测得的过氧化尿素含量_________(填“偏高”、“偏低”或“不变”)。
高三化学实验题困难题查看答案及解析
-
过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为
CO(NH2)2+H2O2
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式
外观
热分解温度
熔点
溶解性
CO(NH2)2·H2O2
白色
晶体
45 ℃
75~85 ℃
易溶于水、有机溶剂
合成过氧化尿素的流程及反应装置图如图:
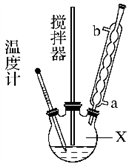
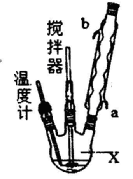
请回答下列问题:
(1)仪器X的名称是________;冷凝管中冷却水从________(填“a”或“b”)口出来。
(2)该反应的温度控制30 ℃而不能过高的原因是_____________________。
(3)步骤①宜采用的操作是________(填字母)。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是______________________________。
(5)准确称取1.000
g产品于250 mL锥形瓶中,加适量蒸馏水溶解,再加2 mL 6 mol·L-1H2SO4,用0.200 0 mol·L-1 KMnO4标准溶液滴定至终点时消耗18.00 mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”“偏低”或“不变”)。
高三化学实验题中等难度题查看答案及解析
-
过氧化尿素(CO(NH2)2·H2O2)是过氧化氢水溶液与尿素的加和物,兼有尿素和过氧化氢的性质,是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。某化学小组同学用低浓度的双氧水和饱和尿素[CO(NH2)2]溶液在30℃条件下用右图装置合成过氧化尿素。请回答下列问题:
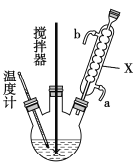
(1)仪器X的名称是______________;
(2)制备过氧化尿素的化学方程式为_______________________,反应时采取的受热方式为_____________;
(3)搅拌器不能选择铁质材料的原因是______________________
(4)过氧化尿素中活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品8.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL6mol·L-1H2SO4,然后用0.2000mol·L-1KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液与尿素不反应)。三次滴定平均消耗KMnO4溶液20.000mL:
①请完善滴定时反应的离子方程式:__MnO
+___H2O2+______==_______________
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量_______(填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量_______(填“合格”或“不合格”),活性氧的质量分数为_________。
高三化学实验题中等难度题查看答案及解析
-
过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式
外观
热分解温度
熔点
溶解性
CO(NH2)2·H2O2
白色晶体
45℃
75~85℃
易溶于水、有机溶剂
合成过氧化尿素的流程及反应装置图如图:
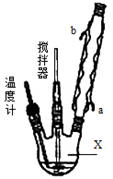
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。
高三化学实验题困难题查看答案及解析
-
过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式
外观
热分解温度
熔点
溶解性
CO(NH2)2·H2O2
白色晶体
45℃
75~85℃
易溶于水、有机溶剂
合成过氧化尿素的流程及反应装置图如图:
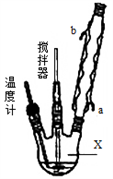
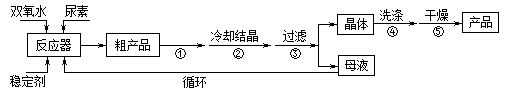
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。
高三化学实验题困难题查看答案及解析
-
过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式
外观
热分解温度
熔点
溶解性
CO(NH2)2·H2O2
白色晶体
45℃
75~85℃
易溶于水、有机溶剂
合成过氧化尿素的流程及反应装置图如图:
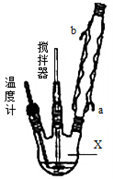
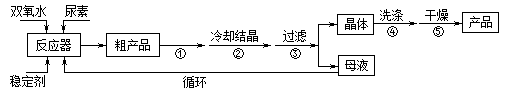
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。
高三化学实验题困难题查看答案及解析
-
过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式
外观
热分解温度
熔点
溶解性
CO(NH2)2·H2O2
白色晶体
45℃
75~85℃
易溶于水、有机溶剂
合成过氧化尿素的流程及反应装置图如图:
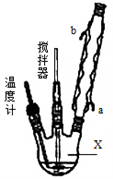
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。
高三化学实验题困难题查看答案及解析
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是________。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
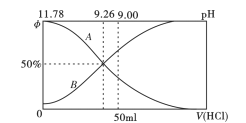
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
③当加入盐酸体积为50ml时,溶被中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
高三化学综合题中等难度题查看答案及解析
-
氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且一定使平衡混合物中NH3的体积分数增大的是________。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下,向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3∙H2O的物质的量分数与加入盐酸的体积的关系如图所示,根据图像回答下列问题。
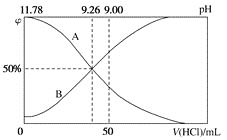
①表示NH3∙H2O浓度变化的曲线是________(填“A”或“B”)。
②NH3∙H2O的电离常数为________(已知lg1.8=0.26)。
③当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3∙H2O)=________mol/L(用数字表示)。
II若液氨中也存在类似水的电离(H2O+H2O⇌H2O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(3)写出液氨的电离方程式:____________________________。
(4)写出碳酸钠溶于液氨后第一级氨解的离子方程式:___________________。
(5)写出碳酸钠的液氨溶液中各离子浓度的大小关系:________________。
高三化学综合题中等难度题查看答案及解析