-
小红与小明两位同学帮助实验老师整理化学药品时,发现分别放在两个试剂瓶中的两片用砂纸磨得光亮的银白色金属、未贴标签。到底它们是哪种金属?两位同学首先对这两种金属X和Y的金属活动性顺序进行实验探究。
进行猜想:
①小红同学猜想:活动性X大于Y。
②小明同学猜想:活动性Y大于X。
(1)设计实验方案,进行实验,获得知识,完成如下实验报告,并回答后续有关问题。
①实验步骤
②实验现象
③结论
1. _____________
2. 将燃着的木条分别放在装金属X、Y的试管口
1. 金属Y表面无明显变化,金属X的表面有气泡产生
2. 气体燃烧
________________
小红的猜想:_____
(选填“正确”或“不正确”)
(2)上述实验之前,用砂纸打磨金属片的目的是________________________,实验老师只知道X、Y是银、铁中的各一种,则根据实验结果说明Y就是________。
(3)你还能想出哪种方法比较X、Y的活动性(用反应的化学方程式表示)___________。
(4)现有的X、Y的混合粉末中含有未反应完的X粉末,若用化学方法将杂质X粉末除去,两个同学经讨论、交流一致认为可选用的除杂试剂是________。
难度: 中等查看答案及解析
-
一次用餐中,小丽对“固体酒精”产生好奇,于是她买回一袋,和同学一起对其进行研究。
(查阅资料)固体酒精中含有酒精、氢氧化钠等物质。
(提出问题)固体酒精中的氢氧化钠是否变质及变质的程度如何?
(做出猜想)
小丽猜想:没有变质,只含有氢氧化钠
小明猜想:全部变质,只含有碳酸钠
你的猜想:部分交变质,含有__________________
氢氧化钠在空气中变质的化学方程式是_______________________。
(实验探究)
小丽取少量固体酒精在水中充分溶解后过滤,取上述滤液于试管中,滴入几滴稀盐酸,无明显现象;小丽说氢氧化钠没变质,小明认为她的结论不正确,其理由是____________。
请你补全实验设计,填写表格中的①②③,证明固体酒精的氢氧化钠是否变质所及变质的程度如何。
实验操作
实验现象
实验结论
____________________
有气泡产生
小丽猜想不成立
____________________
____________________
你的猜想成立
(拓展提升)除去部分变质的氢氧化钠溶液中的杂质,方法是____________。(用化学方程式表示)
难度: 中等查看答案及解析
-
某兴趣小组发现了一包敞口放置的碱石灰样品,为确定其成分,同学们在实验室对这包碱石灰样品展开了探究。
(查阅资料)①碱石灰是由CaO 和NaOH固体混合而成,通常用于吸收二氧化碳或干燥气体;②熟石灰微溶于水,且溶于水放出的热量很少,可以忽略不计;③CaCl2溶液显中性。
(提出猜想)根据资料,同学们分析该碱石灰样品的主要成分可能含有CaO、NaOH、Ca(OH)2、CaCO3、________。
(实验探究)小组同学讨论后设计如下实验进行探究:
实验操作
实验现象
实验结论
步骤一:取少量样品于试管中,加入少量水溶解
无明显放热现象
碱石灰样品中一定不含CaO和__________
步骤二:继续加足量水,振荡、静置、观察
有白色沉淀产生
碱石灰样品中一定含有CaCO3
步骤三:取少量步骤二的上层清液于另一试管中,向其中滴加过量的CaCl2溶液
_______
碱石灰样品中一定含有Na2CO3
(思考分析)小明同学经过分析认为步骤二的结论不准确,原因是______________(用化学方程式表示)。
(解释结论)通过以上探究分析可以得出该碱石灰样品中含有的物质组成可能有________种。
(交流反思)(1)碱石灰是实验室常用的干燥剂,初中化学中常见的___________气体不能用碱石灰干燥。
(2)实验室保存干燥剂的注意事项是要__________保存。
难度: 困难查看答案及解析
-
(2018石家庄长安区质检)某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2),该小组同学进行如下研究。

探究一:该气体的成分
(猜想与假设)小王说:该气体可能是CO2、O2、CO、H2、N2。
小李说:不可能含有CO和H2,因为从药品安全角度考虑,CO有毒,H2________________。
小张说:不可能含有N2,因为___________。
该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
(进行实验)
实验编号
实验操作
实验现象
①
将气体通入澄清石灰水中
澄清石灰水变浑浊
②
将带火星的木条伸入该气体中
带火星的木条没有复燃
(得出结论)
(1)由实验①可知,该气体中肯定含有________,写出该反应的化学方程式________。
(2)由实验②不能确定该气体中不含氧气,理由是_____________。
若要证明含有氧气,请你帮助设计实验_____________。
探究二:维C泡腾片溶液的酸碱性
(3)向维C泡腾片溶液中滴加石蕊溶液,溶液变红,说明溶液显________性。
难度: 中等查看答案及解析
-
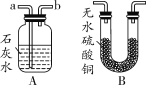
(2018石家庄28中三模)某学校的探究性学习小组发现,铜绿[Cu2(OH)2CO3]受热分解后,除生成CO2和水蒸气外,试管中还有一些黑色粉末状固体。他们通过实验探究,分析黑色固体的组成,并验证产生的气体。
(提出问题)黑色固体是什么?
(猜想与假设)
猜想一:黑色固体可能是氧化铜粉;
猜想二:黑色固体可能是炭粉。
作出这些猜想的依据是____________________和物质所呈现的颜色。
(查阅资料)炭粉不与稀酸反应,也不溶于稀酸;无水硫酸铜遇水变蓝。
(设计实验)
实验操作
实验现象
实验结论
取少量黑色固体于另一支试管中,滴加_________,振荡
______
猜想一正确
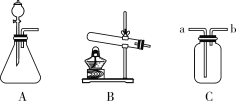
(拓展探究)若用如图装置验证两种气体生成物,应将生成的混合气体依次通过________(将A、B排序)装置。当将气体通入装置A进行验证,气流应从________(填a或b)口通入。
(实验结论)根据以上的实验活动,写出铜绿[Cu2(OH)2CO3]受热分解的化学方程式: ______。
(交流与反思)古代铜币表面绿色铜锈的主要成分是Cu2(OH)2CO3。铜生锈除与空气中氧气和水有关外,还与空气中的二氧化碳有关。为证明必须有此物质存在,需要进行如图所示实验中的________(填装置序号)。

难度: 中等查看答案及解析
-
梧州市某中学化学兴趣小组的同学查资料知道,乙醇(分子式为C2H6O)俗称酒精,通常情况下化学性质稳定,在一定条件下能与氧气反应。现对乙醇与氧气反应进行探究。
(探究活动一)
同学们把绕成螺旋状的红色铜丝在酒精灯的外焰上灼烧到通红,取出铜丝,发现表面变黑,趁热插入装有无水乙醇的试管中(如图),铜丝很快变为红色,并闻到刺激性气味。重复上述操作多次,得到A溶液;经称量,实验前后铜丝质量不变。

铜丝灼烧后生成的黑色物质是___,铜丝除了给反应加热外,还起到__________作用。
(提出问题) 生成的激性气味的气体是什么?
(猜想与假设)有同学提出刺激性气味的气体可能是:
猜想一:SO2猜想二:CO2。猜想三:醋酸(C2H4O2)
(讨论与结论)同学们讨论后发表看法:
小吴认为猜想一不正确,判断的依据是______________
小周认为猜想二也不正确,判断的依据是_____________
小施认为猜想三有可能正确,原因是醋酸具有挥发性,并有刺激性气味。
(探究活动二)
小施同学设计实验验证后,发现猜想三也不正确。请补充完成小施的实验操作和现象:取少量A溶液加入试管中,然后_____________
(讨论与结论)
老师提示这种刺激性气味气体来源于易挥发的B物质,其相对分子质量为44,且含有C、H、O三种元素(氢元素的质量分数不超过20%),由此可推知物质B的分子式为_____
(拓展活动)
(1)同学们再取少量A溶液加入试管中,加少量无水硫酸铜固体,变蓝色(已知:乙醇、B物质遇无水硫酸铜均不显蓝色),说明乙醇在一定条件下与氧气的反应有____生成。
(2)乙醇在微生物(醋酸菌)作用下与氧气反应能生成醋酸,写出该反应的化学方程式__________________;
难度: 困难查看答案及解析
-
化学兴趣小组探究金属的性质时,将一段去除氧化膜的镁条,放入一定量的稀盐酸中,有气泡产生,充分反应后静置,发现试管中有灰白色沉淀。
(提出问题)
灰白色沉淀是什么物质?
(猜想假设)
小华认为灰白色沉淀为碳酸镁(MgCO3),其他同学认为不需要实验就能否定小华的猜想,理由是 。
小宇认为由于反应后氯化镁的生成量偏多,灰白色沉淀为不能再溶解的氯化镁固体。
小彤认为灰白色沉淀为脱落的镁粉细颗粒。
(实验探究1)
实验操作
现象
结论
①取试管中的上层清液,加入适量的氯化镁固体
氯化镁固体 (选填“溶解”或“不溶解”)
小宇猜想错误
②取适量白色沉淀加入足量稀盐酸中
(选填“有”或“没有”)气泡冒出
小彤猜想错误
基于以上探究与分析,原有猜想均遭到了否定。
(查阅资料)
HCl+AgNO3═HNO3+AgCl↓,AgCl是一种白色沉淀。
(实验探究2)
他们又另取灰白色沉淀放入试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管内,玻璃棒上的溶液出现白色浑浊,证明产生了 气体。再将湿润的蓝色石蕊试纸悬于试管口,试纸变 色。
同学们请教老师后得知,足量的镁与稀盐酸反应时,溶液会经历从酸性到碱性且碱性逐步增强的过程,从而生成了碱式氯化镁沉淀.据文献介绍,碱式氯化镁存在多种组成结构,化学通式可表示为Mgx(OH)yClz•mH2O(其中2x﹣y﹣z=0,0≤m≤6)。
(反思拓展)
(1)做镁与稀盐酸反应的实验时,镁条的用量宜少不宜多。
(2)铁片和铜片放入稀硫酸中产生的现象也不相同,据此推测出铁的活性比铜 。还可根据铁和硫酸铜溶液的反应来确定这两种金属的活动性强弱,该反应的化学方程式为 。
难度: 中等查看答案及解析
-
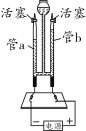
某化学活动小组在一次实验中进行如下图所示实验:
此时双察到U型管左右两侧产生的現象分別是__________:实验后,小組同学充分振荡U型管,发现管内仍有白色固体残留,将混合物过滤后,同学们对滤液成分产生了浓厚的兴趣,于是进行了进一歩的探究活动。
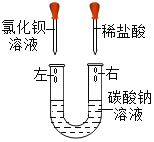
[提出向題]:滤液中可能含有哪些溶质?
[猜想与假设]:猜想一:溶质为NaC1
猜想二:溶质为NaC1和
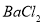
猜想三:溶质为NaC1、
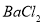 和 HCl
和 HCl[评价与交流]:你认为以上猜想_________不合理,理由是_______________:
则你的猜想为_______________:
[实验探究]:小红为了验证滤液成分,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此得出结论:猜想一成立。小刚认为小红的结论不严密,因为_____。
为验证你的猜想请填写下表:
实验过程
实验现象
实验结论
________
________
你的猜想成立
(归纳与总结]:通过上述实验我们能够总结出:在确定化学反应后所得溶液中溶质成分时,除了考虑生成物外,还要考虑________。
难度: 困难查看答案及解析
-
化学实验过程经常会产生一定量的废液,经过无害化处理可有效防止水体污染。在一次实验课上,兴趣小组的同学们完成了NaOH溶液和Na2CO3溶液的鉴别,并对废液成分展开探究。
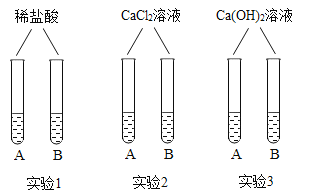
活动一
通过小组合作,同学们完成了右图所示的三组小实验。实验中生成白色沉淀的化学方程式是____________________(写一个)。
活动二
小雪将六支试管中的剩余物倒入一个洁净的大烧杯中(如下图), 充分搅拌、静置。观察到杯内上层是无色溶液,下层有白色沉淀。由此可以确定:上层溶液中一定不含有的离子是__________________、以及一定含有的离子。小组同学对上层溶液中还可能含有的离子进行了如下探究。
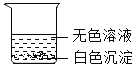
(提出问题)上层溶液中还可能含有什么离子?
(猜想与假设)上层溶液中还可能含有OH-、CO32-、Ca2+中的一种或几种。
(进行实验)
实验步骤
实验现象
实验结论
方案一
①取少量溶液于试管中,滴加无色酚酞溶液②继续滴加稀盐酸
①溶液变红
②产生气泡
①有OH-
②有CO32-、无Ca2+
方案二
取少量溶液于试管中,____________(指示剂除外)
①____________
②___________
①有CO32-、无Ca2+
②有OH-
(反思与评价)
(1)小明同学对方案一提出质疑, 他的理由是________________________。
(2)经过综合分析,最终确定上层溶液中肯定存在的离子有______________________。
(3)将烧杯内物质过滤,滤渣回收,向滤液中加入适量_______________________进行处理后再排放。
难度: 困难查看答案及解析
-
(2017沧州一模)某化学小组同学在实验室对氧化铜的性质进行相关探究活动,请你参与他们的探究,并回答有关问题。
(实验Ⅰ)探究氧化铜与酸、碱的反应;小组同学按图所示方案进行实验,实验中观察到的现象是:试管A中无明显现象,试管B中氧化铜溶解,且__________。由此得出结论:氧化铜不与氢氧化钠溶液反应,可与稀硫酸反应,其反应的化学方程式为________。
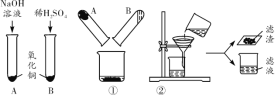
(实验Ⅱ)小组同学按图2所示进行实验:①将实验Ⅰ中反应后的废液混合,发现烧杯中有蓝色沉淀生成;②待烧杯中反应充分,过滤,得滤渣和滤液。请回答:
(1)操作①中生成的蓝色沉淀是________。
(2)操作②的装置中有一处明显错误是_____________。
(3)小组同学经讨论一致认为最终所得滤液中一定不含硫酸,他们的理由是________。
(4)小明认为滤液中溶质的成分除硫酸钠外,还可能含有氢氧化钠、硫酸铜中的一种。
小红认为:溶液没有明显的蓝色,所以肯定不含硫酸铜。
小刚不同意小红的观点,他的理由是_____________。
(实验Ⅲ)滤液中的溶质除硫酸钠外,还含有什么?他们提出三种猜想:①氢氧化钠;②硫酸铜;③既不含氢氧化钠,也不含硫酸铜。请你针对猜想③设计一个实验方案并证明。你的实验方案是:取少许滤液于试管中,___________。
难度: 中等查看答案及解析
-
(2017北京)高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾的某些性质进行研究。
Ⅰ不稳定性
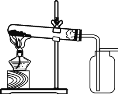
(1)如图所示进行实验,KMnO4受热分解的化学方程式为__________,3.16 gKMnO4产生O2的质量为________ g。
(2)用向上排空气法收集O2的原因是________。
Ⅱ腐蚀性
(查阅资料)KMnO4溶液呈中性、有腐蚀性。
(进行实验)
实验1:将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如下表。
KMnO4溶液浓度
0.002%
0.01%
0.1%
1%
鸡皮的变化
无明显变化
边缘部分变为棕黄色
全部变为棕色
全部变为黑色
实验2:将铜片分别浸泡在4种溶液中进行实验,所得数据如下表。
编号
实验
铜片质量/g
实验前
18小时后
①
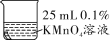
0.54
0.54
②

0.54
0.52
③

0.54
0.54
④
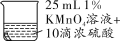
0.54
0.43
(解释与结论)
(3)实验1的目的是_________。
(4)实验2中,通过对比②和④,得出的结论是________。
(5)实验2中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比________(填编号)。
(6)实验2中,铜片被腐蚀的反应如下,补全该反应的化学方程式。
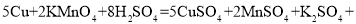 ________
________难度: 中等查看答案及解析
-
某兴趣小组在探究浓硫酸的化学性质时,将浓硫酸滴加到氯化钠固体中并小心的加热,发现有刺激性气味的气体产生,同时发现有白雾,经查资料了解到浓硫酸与氯化钠在加热时会发生反应,写出该反应的化学方程式:___________________________,
该兴趣小组对产生的氯化氢(HCl)气体是否显酸性进行了相关探究。
【进行实验】 同学们根据二氧化碳与水反应的实验探究方法,用三朵由紫甘蓝的汁液染成蓝紫色的纸质干燥小花进行了如图1的三个实验:
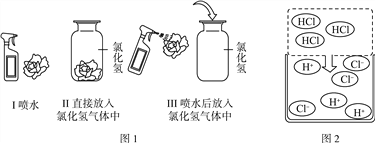
【实验现象】 Ⅰ和Ⅱ中小花不变色;Ⅲ中小花变红色。
【查阅资料】 图2是同学们查阅的氯化氢气体溶于水的示意图。
【实验结论】 氯化氢气体不显酸性。
【交流反思】
(1)从微观角度分析氯化氢气体不显酸性的原因是__________________。
(2)小明向实验Ⅲ中变红的小花上喷足量的稀氢氧化钠溶液,发现小花最后变成黄绿色,写出相关反应的化学方程式______________________________。
(3)紫甘蓝的汁液在酸性溶液中显______色。
(4)下列实验可以用来说明氯化氢气体不显酸性的是____(填字母序号)。
A.测试盐酸的导电性,盐酸能导电
B.干燥的碳酸钠粉末放入氯化氢气体中,不反应
C.氢气与氯气反应,生成氯化氢气体
D.干燥的碳酸钠粉末放入盐酸中,能反应
【拓展应用】
同学们为探究分子的运动情况,在玻璃管两端同时放入蘸有试剂的棉花,做了如图所示实验,发现在玻璃管内形成了白色烟环(成分为氯化铵)且偏向蘸有浓盐酸的棉花一端。
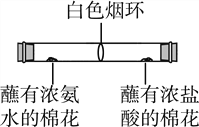
①白色烟环偏向蘸有浓盐酸的棉花一端的原因是____________________;
②写出该反应的化学方程式___________________。
难度: 中等查看答案及解析
-
甜叶菊苷具有高甜度低热能的特点,是一种新型甜味剂,我国是全球最主要的生产国,实验小组欲探究甜叶菊苷的元素组成,进行如下实验:
[提出猜想] 甜叶菊苷由什么元素组成?
[进行实验]小晴取适量的甜叶菊苷按图进行操作,并分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置与火焰上方。
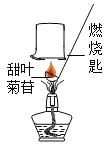
[讨论交流]其他同学认为小晴的实验设计不严谨,原因是____________________________。经改进试验后,检验到甜叶菊苷在氧气中充分燃烧的产物只有二氧化碳和水,由此确定甜叶菊苷中一定含有碳,氢元素。
[继续探究]为了进步确定其元素组成。利用下图进行实验。(已知:装置中C中的氧化铜能确保甜叶菊苷中的碳元素完全转化为二氧化碳)

(1)实验前要通一会儿氮气,目的是_________________。
(2)A装置中发生反应的化学方程式为__________________________。
[数据记录]4.02g甜叶菊苷在C装置中充分燃烧后,D装置增重2.7g, E装置增重8.36g。(产物被完全吸收)
[分析与结论]数据分析: 4.02g 甜叶菊苷中氧元素的质量为___g,由此可以确定甜叶菊苷是由碳,氢,氧元素组成。
[反思评价]若没有F装置,对氧元素质量测定结果的影响是_____________。 (填“偏大”、“偏小”或“无影响”)。
难度: 困难查看答案及解析
-
乙二酸俗称草酸,各种植物都含有草酸,其中以菠菜、茶叶中含量最多。某兴趣小组的同学对草酸晶体的组成进行了下列探究。
(查阅资料)
(1)草酸是一种有机酸。
(2)草酸在加热条件下分解能生成三种化合物。
(实验探究)
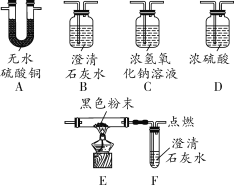
(1)兴趣小组同学取草酸隔绝空气加热,将分解产生的气体先通入A装置,发现无水硫酸铜变蓝,再通入B装置,发现澄清石灰水变浑浊,由此证明草酸分解有____和水生成,从而推断出草酸中含有___元素。
(2)小明认为A、B装置颠倒顺序不会影响验证结果,你是否同意他的观点,请说明原因_______。
(3)小红根据草酸的组成元素及查阅资料的内容,猜想草酸分解也可能有一氧化碳生成,于是继续探究。小红将B装置中导出的气体通入C、D装置,其中C装置中发生反应的化学方程式为________,再依次通过E、F装置,发现E装置中黑色粉末变红,F装置中澄清石灰水变浑浊,由此证明了她的猜想,则E装置中黑色粉末的化学式为_____。
(实验结论)最终同学们得出了草酸的组成元素。
(拓展延伸)
(1)装置F处点燃尾气的原因是_______。
(2)研究物质组成的常用方法是:根据化学反应前后____不变的原则,考虑被探究物质的化学性质,设计实验让物质参与一个化学反应,通过分析反应物或生成物的元素组成进一步确定该物质的组成元素。
难度: 困难查看答案及解析
-
M是生活中常见的金属,MSO4溶液是无色液体,某化学兴趣小组的同学探究M与铜、铁的金属活动性顺序。请你和他们一起进行以下探究活动。
(提出问题)M、铜、铁的金属活动性顺序是怎样的?
(猜想与假设)猜想一:Fe>Cu>M;
猜想二:____________;猜想三:M>Fe>Cu。
(设计与实验一)小组同学取粗细相同的M丝、铜丝、铁丝分别插入均盛有体积相同、溶质质量分数相同的稀盐酸的试管中,几分钟后观察到的现象是____________,由此得出结论:猜想二正确。
(交流与表达)同学们对以上实验结论又有疑问,因为它们刚开始实验时观察到铜丝和铁丝表面均无气泡产生,M表面有少量气泡,经过分析,造成的原因是_____________。
(设计与实验二)为了进一步探究三种金属的活动性顺序,同学们取粗细相同、打磨干净的M丝、铁丝及相关溶液,又进行了如图所示的实验:

(1)试管丙中反应的化学方程式为_________。
(2)同学们经讨论后认为利用实验________组合,也可以得出正确的结论。
(解释与结论)通过以上实验,同学们得出了三种金属的活动性顺序。
(评价与反思)实验结束后,同学们进行了如下反思。
(1)影响金属与酸发生置换反应速率快慢的因素有________。
①温度 ②金属性质和酸的浓度 ③反应物接触面积
(2)探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据_______进行判断(任写一种)。
难度: 中等查看答案及解析
-
(物质组成成分的探究)(2018河北一模)某兴趣小组同学对废旧干电池筒内黑色固体进行探究。
(查阅资料)(1)废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。
(2)二氧化锰不与稀盐酸、稀硫酸发生化学反应。
(猜想)猜想一:黑色固体物质中含有铵盐;
猜想二:黑色固体物质中含有二氧化锰。
(进行实验)
(1)证明黑色固体中含有铵盐的操作:
实验操作
实验现象
结论及反应方程式
①取适量黑色物质与_____混合置于研钵内进行研磨
②再用湿润的红色石蕊试纸检验
____
黑色固体中含有少量的铵盐;
氯化铵与所加物质在研钵内反应的化学方程式为:________
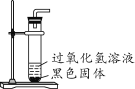
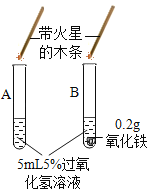
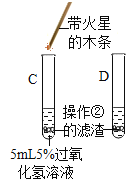
(2)探究黑色物质中是否含有二氧化锰,进行如图所示实验:发现试管内产生较多气泡,检验生成气体的方法是_________,证明猜想二正确。
(交流讨论)有同学提出氧化铜也可能对过氧化氢的分解起催化作用,为了排除黑色固体是氧化铜的可能性,小组同学进行的探究实验是_________(包括实验操作、现象),证明黑色固体中不含氧化铜。
(3)为了回收黑色固体中的二氧化锰,同学们进行了如下操作:
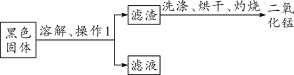
Ⅰ. 操作1的名称是________。
Ⅱ. 灼烧滤渣的目的是____________。
难度: 困难查看答案及解析