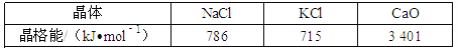-
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为 ( )
A. 直线形 sp杂化 B. 三角形 sp2杂化
C. 三角锥形 sp2杂化 D. 三角锥形 sp3杂化
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 离子晶体的晶格能越大离子键越强
B. 阳离子的半径越大则可同时吸引的阴离子越多
C. 通常阴、阳离子的半径越小、电荷越大,该阴阳离子组成离子化合物的晶格能越大
D. 拆开1mol离子键所需的能量叫该离子晶体的晶格能
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 同一原子中,1s、2s、3s电子的能量逐渐减小
B. 同一原子中,2p、3p、4p能级的轨道数依次增多
C. 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
D. 各能层含有的能级数为n(n为能层序数)
难度: 中等查看答案及解析
-
某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是 ( )。
A. 电子排布式为1s22s22p63s23p63d34s2
B. 该元素为V
C. 该元素为ⅡA族元素
D. 该元素位于d区
难度: 简单查看答案及解析
-
下面关于SiO2晶体网状结构的叙述正确的是
A. 存在四面体结构单元,O处于中心,Si处于4个顶角
B. 最小的环上,有3个Si原子和3个O原子
C. 最小的环上,Si和O原子数之比为1:2
D. 最小的环上,有6个Si原子和6个O原子
难度: 困难查看答案及解析
-
下列有关电离能的说法中正确的是( )
A. 第一电离能越大的原子失电子的能力越强
B. 第一电离能是元素的原子失去核外第一个电子需要的能量
C. 同一周期中,主族元素原子第一电离能从左到右越来越大
D. 可通过一种元素各级电离能的数值,判断元素可能的化合价
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. NH3、CO、CO2都是极性分子
B. CH4、CCl4都是含有极性键的非极性分子
C. HF、HCl、HBr、HI的稳定性依次增强
D. CS2、H2O、C2H2都是直线型分子
难度: 中等查看答案及解析
-
碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为
A. CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大
B. CCl4与I2都是直线型分子,而H2O不是直线型分子
C. CCl4和I2都不含氢元素,而H2O中含有氢元素
D. CCl4和I2都是非极性分子,而H2O是极性分子
难度: 中等查看答案及解析
-
下列有关金属晶体的说法中不正确的是( )
A. 常温下不都是晶体
B. 最外层电子数少于3个的原子不都是金属
C. 任何状态下都有延展性
D. 都能导电、传热
难度: 中等查看答案及解析
-
下面有关“核外电子的运动状态”的说法,错误的是( )
A. 各原子轨道的伸展方向按p、d、f的顺序分别为3、5、7
B. 只有在电子层、原子轨道、原子轨道伸展方向及电子的自旋状态都确定时,电子的运动状态才能被确定下来
C. 原子核外可能有两个电子的运动状态是完全相同的
D. 原子轨道伸展方向与能量大小是无关的
难度: 中等查看答案及解析
-
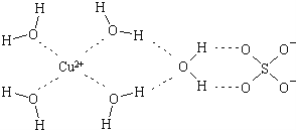
配合物在许多方面有着广泛的应用.下列叙述不正确的是( )
A. CuSO4溶液呈天蓝色是因为含有[Cu(H2O)4]2+
B. 魔术表演中常用一种含硫氰化铁配离子的溶液来代替血液
C. [Ag(NH3)2]+是化学镀银的有效成分
D. 除去硝酸银溶液中的Ag+,可向其中逐滴加入氨水
难度: 简单查看答案及解析
-
下列有关共价键的叙述中,不正确的是( )
A. 某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的价电子数。
B. 水分子内氧原子结合的电子数已经达到饱和,故不能再结合其他氢原子。
C. 非金属元素原子之间形成的化合物也可能是离子化合物
D. 所有简单离子的核电荷数与其核外电子数一定不相等。
难度: 简单查看答案及解析
-
下列各组中的性质比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 ③稳定性:HCl>H2S>PH3 ④还原性:F->Cl->Br-
A. ①②④ B. ③④ C. ①②③ D. ①②③④
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 第三周期所含的元素中钠的第一电离能最小
B. 铝的第一电离能比镁的第一电离能大
C. 在所有元素中,氟的第一电离能最大
D. 钾的第一电离能比镁的第一电离能大
难度: 中等查看答案及解析
-
N—H键键能的含义是( )
A. 由N和H形成1 mol NH3所放出的能量
B. 把1 mol NH3中的共价键全部拆开所吸收的能量
C. 拆开约6.02×1023个N—H键所吸收的能量
D. 形成约1个N—H键所放出的能量
难度: 简单查看答案及解析
-
下列基态原子的价电子排布式中,正确的是
A. 3d94s2 B. 3d44s2 C. 3d104s0 D. 3d84s2
难度: 简单查看答案及解析
-
在常温常压下呈气态的化合物,降温使其固化得到的晶体属于( )
A. 分子晶体 B. 原子晶体 C. 离子晶体 D. 何种晶体无法判断
难度: 简单查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A. 原子半径A>B>D>C B. 原子序数d>c>b>a
C. 离子半径C3->D->B+>A2+ D. 单质的还原性A>B>D>C
难度: 中等查看答案及解析
-
按F、Cl、Br、I顺序递增的是
A. 最外层电子数 B. 第一电离能
C. 非金属性 D. 原子半径
难度: 简单查看答案及解析
-
通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半充满”、“全充满”的时候一般更加稳定,称为洪特规则的特例,下列事实能作为这个规则证据的是( )
①元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
②26Fe2+容易失电子转变为26Fe3+,表现出较强的还原性
③基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2
④某种激发态碳(C)原子电子排布式为1s22s12p3而不是1s22s22p2
A. ①② B. ②③ C. ③④ D. 全部
难度: 中等查看答案及解析
-
有关甲醛分子的说法正确的是 ( )
①C原子采取sp杂化 ②甲醛分子为三角锥型结构
③C原子采取sp2杂化 ④甲醛分子为平面三角形结构
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
下列分子的稳定性的比较正确的是( )
A. HF>HI B. CH4<SiH4 C. PH3>NH3 D. H2O<H2S
难度: 中等查看答案及解析
-
下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是( )
①H2O ②NH3 ③Cl- ④CN- ⑤CO
A. ①② B. ①②③ C. ①②④ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列各组微粒属于等电子体的是( )
A. 12CO2和14CO B. H2O和CH4
C. N2和13CO D. NO和CO
难度: 简单查看答案及解析
-
下列分子晶体,关于熔、沸点高低的叙述中,正确的是( )
A. Cl2>I2 B. SiCl4>CCl4
C. NH3<PH3 D. C(CH3)4>CH3(CH2)3CH3
难度: 困难查看答案及解析
-
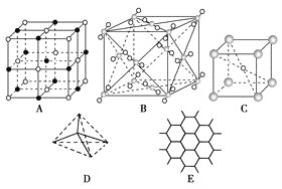
对于氯化钠晶体,下列描述正确的是( )
A.它是六方紧密堆积的一个例子
B.58.5 g氯化钠晶体中约含6.02×1023个NaCl分子
C.与氯化铯晶体结构相同
D.每个Na+与6个Cl-作为近邻
难度: 简单查看答案及解析
-
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界中最硬的原子晶体。下列叙述错误的是( )
A. WX4是沼气的主要成分 B. 固态X2Y是分子晶体
C. ZW是原子晶体 D. 玛瑙、水晶和玻璃的成分都是ZY2
难度: 简单查看答案及解析
-
下列关于晶格能的说法中正确的是( )
A. 晶格能指形成1 mol离子键所放出的能量
B. 晶格能指破坏1 mol离子键所吸收的能量
C. 晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量
D. 晶格能的大小与晶体的熔点、硬度都无关
难度: 简单查看答案及解析
-
下列有关离子晶体的数据大小比较不正确的是( )
A. 熔点:NaF>MgF2>AlF3
B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaCl>CaF2
D. 硬度:MgO>CaO>BaO
难度: 中等查看答案及解析
-
短周期非金属元素X和Y能形成XY2型化合物,下列有关XY2的判断不正确的是( )
A. XY2一定是分子晶体
B. XY2的电子式可能是:
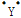 : :X: :
: :X: :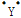 :
:C. XY2水溶液不可能呈碱性
D. X可能是ⅣA,ⅤA或ⅥA族元素。
难度: 中等查看答案及解析