-
在下列各说法中,正确的是:
A. 已知C(金刚石,s)= C(石墨,s); △H= —1.89kJ/mol,则金刚石比石墨稳定
B. 1mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
C. H2SO4与Ba(OH)2反应生成1molH2O时放出的热叫做中和热
D. 热化学方程式中的化学计量数表示物质的量,可以是分数
难度: 中等查看答案及解析
-
某反应过程中体系的能量变化如图所示,下列说法错误的是
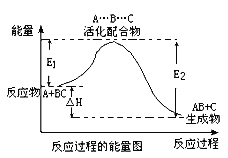
A. 该反应不一定能自发进行
B. E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C. 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应
D. 加入合适催化剂,△H不变,E1、E2也不变
难度: 中等查看答案及解析
-
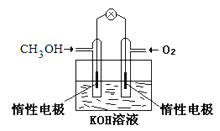
将如图所示实验装置的K闭合,下列判断正确的是
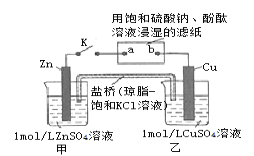
A. b电极上发生还原反应 B. 片刻后甲池中c(Cl-)增大
C. 电子沿Zn→a→b→Cu 路径流动 D. 片刻后可观察到滤纸b点变红色
难度: 中等查看答案及解析
-
下列描述中正确的是
A. 电解熔融的氧化铝制取金属铝,用铁作阳极
B. 电解饱和食盐水制取产品,用阳离子交换膜
C. 雨水酸性较强时,生铁片仅发生析氢腐蚀
D. 铁上镀铜,铁作阳极
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e— +2OH—= Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO42-+ 4H2O
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
难度: 简单查看答案及解析
-
根据下列有关图象,说法正确的是
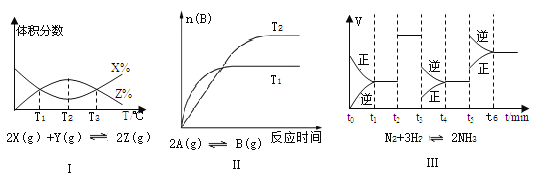
A. 由图Ⅰ知,该反应的△H>0 B. 由图Ⅱ知,该反应为放热反应
C. 由图Ⅲ知,t3时一定是采取降低反应温度的措施 D. 由图Ⅲ知,反应在t6时,NH3体积分数最大
难度: 中等查看答案及解析
-
25℃时,在20mL,0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是

A. 在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
B. 在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
C. 在B点:c(OH-)﹦c(H+),c(Na+)﹦c(CH3COO-)
D. 在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
难度: 中等查看答案及解析
-
在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是
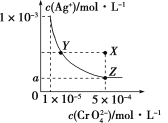
A. T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B. 向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y 点变为X点
C. T ℃时,Ag2CrO4的Ksp为1×10-8
D. 图中a=
×10-4
难度: 简单查看答案及解析
-
已知:AgBr比AgCl更难溶,将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,发生的反应为
A. 只有AgBr沉淀生成 B. AgCl与AgBr沉淀等量生成
C. AgCl与AgBr沉淀都有,但以AgCl沉淀为主 D. AgCl与AgBr沉淀都有,但以AgBr沉淀为主
难度: 中等查看答案及解析
-
有0.2 mol某有机物和0.5 mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。 产物依次通过浓硫酸时,浓硫酸的质量增加了 10.8 g;再通过灼热的氧化铜时,氧化铜的质量减轻了 3.2 g;又通过碱石灰时,碱石灰的质量增加了17.6 g。该有机物的分子式是
A. C2H4 B. C2H6O2 C. C2H6O D. C3H6O3
难度: 困难查看答案及解析
-
为了提纯下列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是
选项
被提纯的物质
除杂试剂
分离方法
分离方法
A
己烷(己烯)
溴水
分液
B
淀粉溶液(NaCl)
水
过滤
过滤
C
苯(甲苯)
酸性高锰酸钾溶液、NaOH溶液
分液
分液
D
甲烷(乙烯)
KMnO4酸性溶液
洗气
洗气
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质既不能使溴水褪色,又不能使酸性高锰酸钾溶液褪色的是
①乙烷 ②乙烯 ③乙炔 ④苯 ⑤甲苯 ⑥溴乙烷 ⑦聚丙烯 ⑧环己烯
A. ①②③⑤ B. ①④⑥ C. ①④⑥⑦ D. ②③⑤⑧
难度: 中等查看答案及解析
-
恒温、恒容,向1L密闭容器中加入5molX,5molY,发生下列反应:aX(g)+bY(g)
cZ(g),达到平衡如图。下列说法一定正确的是
A. 又加入1molX,正反应速率增大,逆反应速率不变
B. 又加入1molX、1molY,达到新平衡,X的转化率减小
C. △H不变,是该反应平衡的标志
D. 某时刻,X、Y、Z三者物质的量分别为5mol、3mol、2mol,则此时逆反应速率大于正反应速率
难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:aA(g)+bB(g)
cC(g),达到平衡后,测得A的浓度为0.5mol・L-1,在温度不变的情况下,将容器的容积扩大到原来的两倍,测得A的浓度为0.3mol・L-1,则下列判断正确的是
A. a+b<c B. C的体积分数下降
C. B的浓度增大 D. A的转化率增大
难度: 困难查看答案及解析
-
某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,下列操作会引起实验结果偏大的是
A. 滴定前,滴定管尖嘴有气泡,滴定后无气泡
B. 在锥形瓶装液前,留有少量蒸馏水
C. 锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D. 用酸式滴定管量取液体时,读数,之前俯视,之后平视
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中,Fe3+的浓度之比大于10
B. 常温下,浓度均为0.1 mol·L-1的①醋酸、②盐酸、③醋酸钠溶液,水的电离程度的顺序为③>①>②
C. 将相同体积的pH=3的硫酸和pH=11的NaOH溶液混合,所得溶液一定为中性
D. 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是a>c>b
难度: 中等查看答案及解析
-
将标准状况下2.24L CO2缓慢通入1L0.15mol•L-1的NaOH溶液中,气体被充分吸收,下列关系不正确的是
A. c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B. c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
C. 2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)]
D. 2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+)
难度: 困难查看答案及解析
-
下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. CH3-CH=CH-CH=CH2无顺反异构
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为
,它与硝酸反应,可生成5种一硝基取代物
难度: 中等查看答案及解析
-
已知常温下浓度为0.1mol/L的几种溶液的pH如下表。下列有关说法不正确的是
溶质
NaF
Na2CO3
NaClO
NaHCO3
pH
7.5
11.6
9.7
8.3
A. 同温度同浓度下,酸性由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O
HF+OH-的平衡常数约为9×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:c(CO32-)+c(HCO3-)+ c(H2CO3)=0.2mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(F-)>c(Na+)> >c (H+)>c(OH-)
难度: 困难查看答案及解析
-
已知草酸为二元弱酸:常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
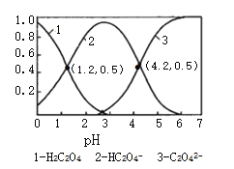
A. pH=1.2溶液中:c(K+)+c(H+)═c(OH﹣)+c(H2C2O4)
B. H2C2O4的第一步电离,平衡常数为10-1.2
C. 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度增大
难度: 困难查看答案及解析