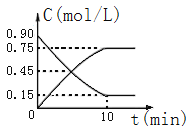-
甲醇是一种重要的可再生能源。已知:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a kJ/mol,CO(g)+2H2(g)=CH3OH(g)△H=b kJ/mol。
(1)写出由CH4和O2制取CH3OH(g)的热化学方程式:__________________________。
(2)在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | a | 0.10 | c | d | e |
| c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。该反应的化学方程式为N2O4 2NO2。
2NO2。
①0~20s内N2O4的平均反应速率为__________。
②该反应的平衡常数表达式K=______________,在80℃时该反应的平衡常数K值为____(保留2位小数)。
③下列说法正确的是___________。
A.K值越大,N2O4的转化率越高
B.加压,平衡逆向移动,气体颜色变浅
C.增大N2O4的浓度,新平衡建立过程中正反应速率不断加快
D.起始条件相同,将等量的N2O4分别在A、B两个相同的容器中反应建立平衡,A保持恒温、恒容;B保持恒温、恒压,达到平衡后,A中的N2O4平衡转化率小于B
(3)可逆反应 A(g)+2B(g) xC(g)。
xC(g)。
①在一容积不变的绝热密闭容器中充入10mol A和20molB,一定能判断该反应达到化学平衡状态的是__(填选项字母)。
A.B的消耗速率等于A的生成速率的2倍 B.温度不变
C.A的转化率和B的转化率相等 D.气体密度不变
E.混合气体的平均相对分子质量不再改变
②恒温:若在体积可变的密闭容器中反应,压缩容器,达新平衡时A的平衡浓度如下:
| 容器体积 | 4L | 2L | 1L |
| A的平衡浓度 | 2mol/L | 3mol/L | 6.5mol/L |
则容器体积由4L至2L过程中,平衡______移动(填正向或逆向);解释容器体积由2L压缩至1L,平衡移动方向,及其可能的原因______________________。
-
(14分)甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH =b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式: 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率υ(H2)= _。

(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池总反应的离子方程式:___________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
-
甲醇是一种重要的可再生能源.
(1)利用二氧化碳合成甲醇来替代汽油。
已知:2CH3OH(l) +3O2(g)=4H2O(l)+2CO2(g) △H=—1453.0 kJ/mol,2H2(g) + O2(g)=2H2O(l) △H=—571.6 kJ/mol
计算CO2(g)+3H2(g) =CH3OH(l)+ H2O(l)的反应热△H=___________ kJ/mol。
(2)下图是反应CO(g)+2H2(g) CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=______________.
CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=______________.
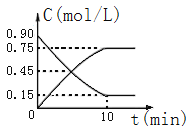
(3)在一恒容的密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g) CH3OH(g)△H并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图所示.
CH3OH(g)△H并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图所示.
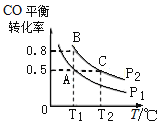
①能判断该反应达到化学平衡状态的是_____(填选项字母).
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较平衡常数KA、KB、KC的大小:____________
(4)在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是________(填“T1”或“T2” 或“T3”);

(5)电化学在我们的生产生活中占有越来越重要的地位。

①燃料电池是一种绿色环保、高效的化学电源。图为甲醇燃料电池,则负极反应式为_____________。
②用甲醇燃料电池电解300mL饱和食盐水(惰性电极),则电解的离子方程式为____________________,电解一段时间后,当溶液的pH值为13时,消耗O2的质量为_______g。(忽略溶液体积变化)
-
(1)甲醇是重要的可再生燃料。已知在常温常压下:
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)ΔH=-1 275.6 kJ/mol
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ/mol
H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
(2)氧化还原反应与生产、生活、科技密切相关。请回答下列问题:
①银制器皿日久表面变黑是因为表面生成了Ag2S的缘故,该现象属于________腐蚀。如果加入一定浓度硝酸将发生反应3Ag2S+8HNO3===6AgNO3+3S↓+2NO↑+4H2O,同时Ag与硝酸反应生成AgNO3、NO、H2O,当生成22.4 mL的气体时,参加反应硝酸的物质的量为________。
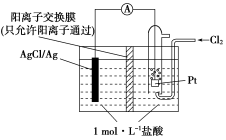

图1 图2
②在如图1所示的原电池装置中,负极的电极反应为______________,H+的移动方向为________;(填“从右向左”,“从左向右”)电池总反应方程式为___________________,当电路中转移0.1 mol e-时,交换膜左侧溶液中离子减少的物质的量为________。
③电解NO制备NH4NO3原理如图2所示,接电源正极的电极为________(填X或Y),X电极反应式为_________________,为使电解产物完全转化为NH4NO3,需要补充的物质A的化学式为_____________。
-
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)===2CO(g)+4H2(g) ΔH=-71 kJ/mol
②CO(g)+2H2(g)===CH3OH(l) ΔH=-90.5 kJ/mol
③CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ/mol
下列不能得出的结论是( )
A.反应②不需要加热就能进行
B.CO(g)+2H2(g)===CH3OH(g) ΔH>-90.5 kJ/mol
C.甲醇的燃烧热ΔH=-764 kJ/mol
D.若CO的燃烧热ΔH=-283.0 kJ/mol,则H2的燃烧热ΔH=-285.8 kJ/mol
-
甲醇(CH3OH)广泛用作燃料电池的燃料,可由天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH=-71 kJ·mol-1
②CO(g)+2H2(g)===CH3OH(l)ΔH=-90.5 kJ·mol-1
③CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
(1)甲烷的燃烧热为____。
(2)CH4和O2反应生成CH3OH(l)的热化学方程式为____。
-
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中正确的是 ( )
A. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= +890 kJ·mol-1
B. CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= +890 kJ·mol-1
C. CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= -890 kJ·mol-1
D. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= -890 kJ·mol-1
-
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中正确的是 ( )
A. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= +890 kJ·mol-1
B. CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= +890 kJ·mol-1
C. CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= -890 kJ·mol-1
D. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= -890 kJ·mol-1
-
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中正确的是 ( )
A. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= +890 kJ·mol-1
B. CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= +890 kJ·mol-1
C. CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= -890 kJ·mol-1
D. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= -890 kJ·mol-1
-
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中正确的是 ( )
A. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= +890 kJ·mol-1
B. CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= +890 kJ·mol-1
C. CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= -890 kJ·mol-1
D. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= -890 kJ·mol-1
2NO2。
xC(g)。