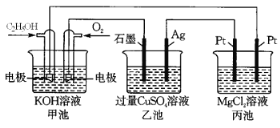
-
化学与科技、生产、生活密切相关。下列说法正确的是
A. 纯碱可以用作锅炉除垢时CaSO4的转化剂
B. 加入“聚铁”净水剂可以使海水淡化
C. 草木灰可以肥田,还可以降低土壤的碱性
D. 向汽油中添加甲醇后,该混合燃料的热值不变
难度: 简单查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
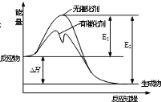
A. 该反应为吸热反应
B. 升高温度,不改变活化分子百分数
C. 使用催化剂会使该反应的反应热发生改变
D. △H =-(E2-E1)
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解平衡常数)越小
B. 铁管镀锌层局部破损后,铁管仍不易生锈
C. 铜既可以发生析氢腐蚀又可以发生吸氧腐蚀
D. 不能用红外光谱区分C2H5OH和CH3OCH3
难度: 中等查看答案及解析
-
下列说法不正确的是
①盐酸与足量锌片反应时,加入少量硫酸铜溶液可以加快反应速率且不影响生成氢气的物质的量
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
③对反应3H2(g)+N2(g)
2NH3(g),在一密闭容器中进行,充入氦气,则化学反应速率一定不变
④对于反应3KSCN(aq)+ FeCl3(aq)
Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
A. ①②④ B. ②③ C. ②③④ D. ①③④
难度: 中等查看答案及解析
-
有关电化学知识的描述正确的是
A. Cu+H2SO4=CuSO4+H2↑这个反应可设计成原电池
B. 利用Cu+2FeCl3=CuCl2+2FeCl2,可设计如图所示原电池装置,盐桥内K+向FeCl3溶液移动
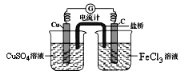
C. 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,铁作负极,铜作正极,其负极反应式为Fe-2e-=Fe2+
D. 由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-=Mg(OH)2
难度: 中等查看答案及解析
-
下列表述中,说法正确的个数是
①pH=6的溶液一定是酸性溶液
②用Na2CO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③为保存FeCl3溶液,要在溶液中加少量盐酸
④25℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
⑤如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡
⑥0.2 mol/L醋酸溶液加水稀释,电离程度增大,c(H+)一定增大
⑦用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体
⑧用广范pH试纸测得某溶液的pH为2.3
A. 1 B. 2 C. 3 D. 4
难度: 困难查看答案及解析
-
以下实验设计能达到实验目的是
实验目的
实验设计
A
探究浓度对反应速率的影响
盛有4mL1mol/L KMnO4酸性溶液的两支试管,一支加入2 mL 0.1mol/LH2C2O4溶液,另一支加入2mL0.2 mol/L H2C2O4溶液
B
制备无水AlCl3
蒸发Al与稀盐酸反应后的溶液
C
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
D
比较铜和镁的金属活动性强弱
用石墨电极电解Mg(NO3)2、Cu(NO3)2的混合液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知 C—C 单键可以绕键轴旋转。某烃的结构简式如图,下列说法中正确的是
A. 该烃在核磁共振氢谱上有 6组信号峰
B. 1mol该烃完全燃烧消耗16.5mol O2
C. 分子中至少有 10个碳原子处于同一平面上
D. 该烃是苯的同系物
难度: 中等查看答案及解析
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
难度: 中等查看答案及解析
-
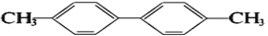
对于反应N2O4(g)
2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
A. A、C两点的正反应速率的关系为A>C
B. A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C. 维持P1不变,E→A所需时间为x;维持P2不变,D→C所需时间为y,则x<y
D. 使E状态从水平方向到达C状态,从理论上来讲可选用的条件是从P1突然加压至P2
难度: 中等查看答案及解析
-
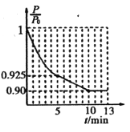
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.
C.
D.Ka(HF)
难度: 极难查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 含有大量NO3-的溶液:H+、NH4+、I-、S2O32-
B. 中性溶液:Fe3+、Al3+、NO3-、SO42-
C.
=1×10-12的溶液:K+、AlO2-、CO32-、Na+
D. 由水电离出的c(H+)=10-12mol/L的溶液:Na+、K+、CO32-、SO42-
难度: 中等查看答案及解析
-
下列关系的表述中,正确的是
A. 等体积、等物质的量浓度的NaCl溶液中离子总数小于NaClO溶液中离子总数
B. 中和pH和体积都相同的盐酸和醋酸,消耗氢氧化钠的物质的量之比为1:1
C. 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3、⑤NH4HCO3中c(CO32-)的大小关系为:②﹥④﹥③﹥⑤﹥①
D. 0.2 mol/L的CH3COONa和0.1 mol/L的盐酸等体积混合溶液显酸性:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)>c(OH-)
难度: 困难查看答案及解析
-
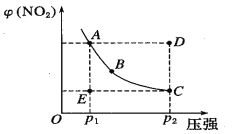
在某温度时,将n mol/L的氨水滴入10 mL1.0 mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
A. a点KW=1.0×10-14
B. 水的电离程度:b﹥a﹥c﹥d
C. b点:c(NH4+)﹥c(Cl-)﹥c(H+)﹥c(OH-)
D. 25℃时NH4Cl水解平衡常数为(n-1)×10-7(用n表示)
难度: 中等查看答案及解析
-
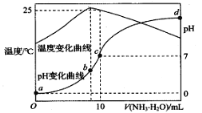
常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是
A. Ag2C2O4+2Cl-
2AgCl+C2O42-的平衡常数为109.04
B. N点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ksp(Ag2C2O4)的数量级等于10-7
难度: 困难查看答案及解析
-
常温下,下列所述有关离子浓度之间的关系错误的是
A. 将0.2mol/L NaHCO3溶液与0.1mol/L KOH溶液等体积混合:3c(K+)+c(H+)=c(OH-) +c(HCO3-)+2c(CO32-)
B. 浓度均为0.1mol/L 的CH3COOH 与CH3COONa溶液等体积混合后pH=5,则混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-5-10-9) mol/L
C. 将CO2通入0.1 mol/L Na2CO3溶液至中性,溶液中2c (CO32-) +c (HCO3-)=0.1mol/L
D. 0.1 mol/L Na2CO3溶液中存在:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
难度: 中等查看答案及解析
-
我国科研人员研制出一种室温Na-CO2电池。该电池吸收CO2的工作原理如图所示。吸收的全部CO2中,有
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法不正确的是
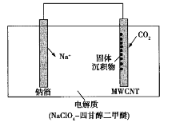
A. 钠箔为负极,发生氧化反应
B. 每吸收22.4 LCO2,转移电子数为
mol
C. 正极反应式:4Na++3CO2+4e-=2Na2CO3+C
D. Na+通过电解质移向MWCNT极
难度: 中等查看答案及解析
-
下列关于各图的说法中正确的是
A.
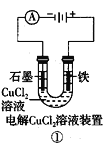 ①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体
①中阳极处能产生使湿润淀粉-KI试纸变蓝的气体B.
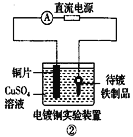 ②中待镀铁制品应与电源正极相连
②中待镀铁制品应与电源正极相连C.
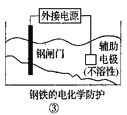 ③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法
③中钢闸门应与外接电源的负极相连,称为牺牲阳极的阴极保护法D.
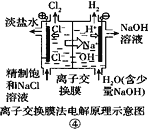 ④中离子交换膜可以避免生成的Cl2与NaOH溶液反应
④中离子交换膜可以避免生成的Cl2与NaOH溶液反应难度: 中等查看答案及解析
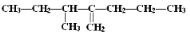 的键线式为________________________。
的键线式为________________________。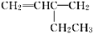 ______________________。
______________________。