-
将木材隔绝空气加强热,可得到木煤气、木焦油和木炭等,这种加工方法化工生产中称为
A.分馏 B.裂化 C.裂解 D.干馏
难度: 简单查看答案及解析
-
含硫单质的水可防治皮肤病,而硫难溶于水,微溶于酒精,易溶于CS2,要增大硫在水中的分散程度,可将硫先放入溶剂R中,再将所得液体分散在水中,则R可以是
A.CS2 B.酒精 C.CCl4 D.盐酸
难度: 简单查看答案及解析
-
取0.5mL某溶液,要将其中的Fe3+和Cu2+先分离再检验,适宜的方法是
A.纸上层析法 B.萃取分液法 C.结晶法 D.蒸馏法
难度: 简单查看答案及解析
-
把生铁冶炼成钢,目的是
A.改善性能,增大用途
B.除去硫、磷和过多的碳,调整合金元素的含量
C.副产磷肥、水泥等
D.用红棕色炉气制取水煤气
难度: 简单查看答案及解析
-
在对电子运动状态的描述中,确定一个“轨道”的方面包括
①电子层 ②电子亚层 ③电子云的伸展方向 ④电子的自旋状态
A.①②③④ B.①②③ C.①② D.①
难度: 简单查看答案及解析
-
碳元素的一种单质的化学式为C68,则关于C68的叙述错误的是
A.属分子晶体 B.可溶于CCl4 C.固态可导电 D.熔点高于C60
难度: 简单查看答案及解析
-
以下物质的工业制备所用主要原料(括号内物质)不符合事实的是
A.乙烯(乙醇) B.顺丁橡胶(石油裂解气)
C.碘(海带) D.溴(海水晒盐后的余液)
难度: 简单查看答案及解析
-
下列气体除杂所用试剂错误的是(括号内为杂质)
A.Cl2(HCl) :饱和食盐水 B.H2(H2S、HCl、H2O):碱石灰
C.SO2(HCl):Na2SO3溶液 D.CO2(H2S):CuSO4溶液
难度: 中等查看答案及解析
-
根据下表数据,则与HClO3比HClO具有的是
Cl-O键键长(pm)
Cl-O键能(KJ/mol)
HClO
170
209
HClO3
157
244
A.更高的沸点 B.更强的酸性
C.Cl-O断裂放出的能量更少 D.更易放出原子氧
难度: 中等查看答案及解析
-
非金属元素R位于第三周期,其原子的最外层有n个电子,则以下叙述错误的是
A.R原子的电子数为10+n B.R能形成Rn-离子
C.R的最高氧化物为R2On或ROn/2 D.R的气态氢化物的化学式是H8-nR
难度: 中等查看答案及解析
-
用定量的方法,可用于鉴别邻甲基苯酚和间甲基苯酚的试剂是
A.酸性高锰酸钾溶液 B.浓溴水 C.氯化铁溶液 D.氢氧化钠溶液
难度: 简单查看答案及解析
-
以下实验所用的试剂不合理的是
选项
实验目的
所用试剂
A
比较Fe3+和Cu2+的氧化性
FeCl3溶液和Cu
B
比较镁和铝的金属性
MgCl2溶液、AlCl3溶液、NaOH溶液
C
比较硫和氯的非金属性
氢硫酸、氯气
D
比较苯酚和碳酸的酸性
0.1mol/L苯酚钠、0.1mol/L碳酸钠溶液pH试纸
难度: 中等查看答案及解析
-
如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液。若两电极直接连接或外接电源,石墨上可能发生的反应是

①2H++2e→H2↑ ②O2+4e+2H2O→4OH- ③2Cl--2e→Cl2↑
A.① B.② C.①② D.①②③
难度: 中等查看答案及解析
-
亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但在酸性溶液发生分解:
5HClO2→4ClO2+H++Cl-+2H2O.
向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为pH相同的稀硫酸,开始时反应缓慢,稍后产生气体速度较快,速度变化的原因是
A.逸出ClO2使生成物浓度降低 B.酸使HClO2的分解加速
C.溶液中的H+起催化作用 D.溶液中的Cl-起催化作用
难度: 中等查看答案及解析
-
测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数
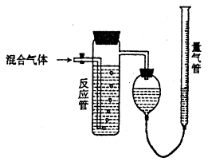
A.偏高 B.偏低 C.无影响 D.无法确定
难度: 中等查看答案及解析
-
氨基呈碱性,氨基酸呈两性。把甘氨酸(氨基乙酸)放入一定pH的溶液中,所得溶液中不能同时大量存在的微粒是①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-
A.①与② B.①与③ C.②与③ D.②与④
难度: 中等查看答案及解析
-
冶铁的原料有铁矿石、焦炭、空气和石灰石。测得某冶铁高炉煤气的体积分数为CO-0.28;CO2-0.10; N2-0.58,棕色烟尘-0.04(不含氮元素)。若每生产1000kg生铁排放煤气2400 m3,则至少需要补充空气(空气体积分数:N2-0.8 、O2-0.2;气体都在同温同压下测定)
A.1392 m3 B.1740 m3 C.1920 m3 D.2304 m3
难度: 困难查看答案及解析
-
往Ba(C1O)2溶液中通入足量SO2气体后,溶液中的溶质是
A.H2SO4 B.HCl C.HClO D.Ba(HSO3)2
难度: 中等查看答案及解析
-
密闭的真空容器中放入一定量CaO2固体,发生反应2CaO2(s)
2CaO(s)+O2(g)并达到平衡。保持温度不变,缩小容器容积为原来的三分之二,重新平衡后,下列叙述正确的是
A.平衡常数减小 B.CaO的量减少
C.氧气浓度不变 D.CaO2的量不变
难度: 中等查看答案及解析
-
某水体溶有Ca2+、Mg2+、HCO3-三种离子,可先加足量消石灰,再加足量纯碱以除去Ca2+、Mg2+。以下离子方程式肯定不符合反应事实的是
A.Mg2++2HCO3-+Ca2++2OH- →MgCO3↓+CaCO3↓+2H2O
B.Mg2++2HCO3-+2Ca2++4OH- →Mg(OH)2↓+2CaCO3↓+2H2O
C.Mg2++3HCO3-+3Ca2++5OH- →Mg(OH)2↓+3CaCO3↓+3H2O
D.Ca2++CO32- →CaCO3↓
难度: 困难查看答案及解析
-
25℃时,有v1mL pH=9的氨水(A)和v2mL pH=10的氨水(B),v3mL pH=10的NaOH溶液(C),它们能中和同量的盐酸。以下叙述正确的是
A.v1>10v2
B.加少量水稀释,氨水中c(NH4+)/c(NH3•H2O)都减小
C.v2=v3
D.中和热A=B=C
难度: 中等查看答案及解析
-
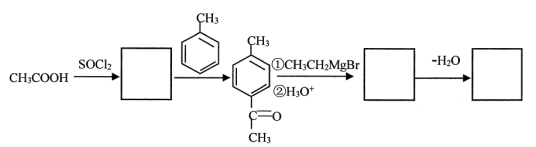
磷酸分子间脱水会形成多种聚磷酸,它们的钠盐是广泛使用的食品添加剂。将48gNaOH与58.8g固态纯H3PO4在一定温度下加热,得到79.8g固体A和27g水,则A可能是
A.Na3PO4 B.Na4P2O7
C.Na4P2O7 和Na5P3O10 D.Na3PO4、Na4P2O7和Na5P3O10
难度: 极难查看答案及解析
-
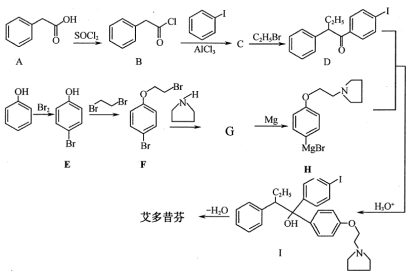
(本题共10分)苯是重要的化工原料,以下是某酮酸E的合成路线。
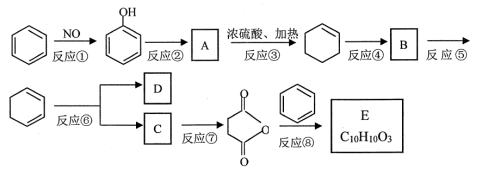

40.以上合成路线中,属于氧化反应的有:反应⑥和反应________(填反应编号);反应⑤的反应条件是_______。
41.写出结构简式A________________; B_____________________
42.己知C的分子式为C4H6O4,则D的结构简式为______________;分离C和D的方法是_________________。
43.不能由
直接制取
,原因是______________________________________。
44.写出反应⑧的化学方程式_______________________________________________。
难度: 中等查看答案及解析