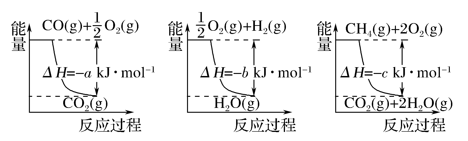
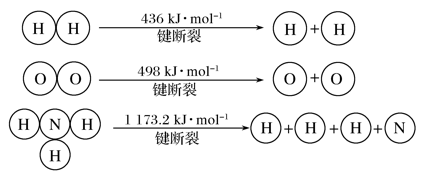
-
下列说法中正确的是( )
A. 热化学方程式中,如果没有注明温度和压强,则表示的反应热是在标准状况下测得的
B. 升高温度或加入催化剂,可以改变化学反应的反应热
C. 据能量守恒定律,反应物的总能量一定等于生成物的总能量
D. 若生成与断裂1 mol H—O键对应放出和吸收的能量分别为a kJ、b kJ,则a=b
难度: 中等查看答案及解析
-
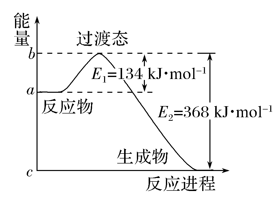
已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )
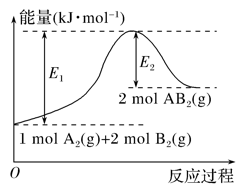
A. 该反应是放热反应
B. 该反应的ΔH=-(E1-E2) kJ· mol-1
C. 该反应中反应物的键能总和大于生成物的键能总和
D. 由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量
难度: 中等查看答案及解析
-
关于如图所示转化关系(X代表卤素),说法不正确的是( )
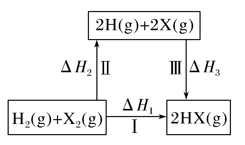
A. 2H(g)+2X(g)===2HX(g) ΔH3<0
B. 生成HX的反应热与途径无关,所以ΔH1=ΔH2+ΔH3
C. Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D. 生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
难度: 中等查看答案及解析
-
根据如图所示的反应判断,下列说法中错误的是( )
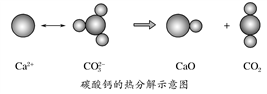
A. CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B. 该反应的焓变大于零
C. 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D. 由该反应可推出凡是需要加热才能发生的反应均为吸热反应
难度: 中等查看答案及解析
-
下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法中正确的是( )
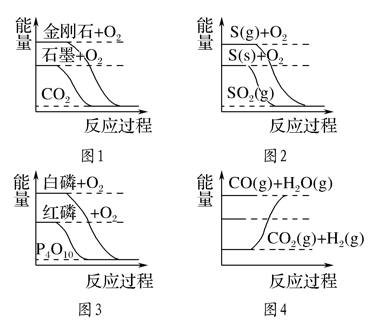
A. 由图1知,石墨转变为金刚石是吸热反应
B. 由图2知,S(g)+O2(g)===SO2(g) ΔH1,S(s)+O2(g)===SO2(g) ΔH2,则ΔH1>ΔH2
C. 由图3知,白磷比红磷稳定
D. 由图4知,CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是( )
A. 已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
B. 已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 在稀溶液中:H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3kJ/mol,若将含0.6molH2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
D. 需要加热的反应说明它是吸热反应
难度: 中等查看答案及解析
-
已知:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1,
②H2(g)+O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
A. 向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
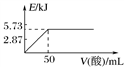
B. H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
C. 氢气的标准燃烧热为241.8 kJ·mol-1
D. 若反应②中水为液态,则同样条件下的反应热:ΔH>ΔH2
难度: 中等查看答案及解析
-
在298 K、100 kPa时,已知:2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A. ΔH3=ΔH1+2ΔH2
B. ΔH3=ΔH1+ΔH2
C. ΔH3=ΔH1-2ΔH2
D. ΔH3=ΔH1-ΔH2
难度: 中等查看答案及解析
-
根据以下三个热化学方程式:
①2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH1=-Q1 kJ·mol-1,
②2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH2=-Q2 kJ·mol-1,
③2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH3=-Q3 kJ·mol-1。
判断Q1、Q2、Q3三者关系正确的是(Q1、Q2、Q3均大于0)( )
A. Q1>Q2>Q3 B. Q1>Q3>Q2
C. Q3>Q2>Q1 D. Q2>Q1>Q3
难度: 中等查看答案及解析
-
根据如图关系(图中计量单位为mol)计算2NO(g)+2H2(g)===N2(g)+2H2O(g)的ΔH为( )
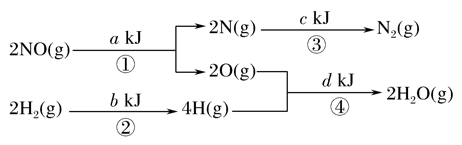
A. (a+b-c-d)kJ·mol-1 B. (c+a-d-b)kJ·mol-1
C. (c+d-a-b)kJ·mol-1 D. (c+d-a-b)kJ·mol-1
难度: 中等查看答案及解析
-
已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1
H—H键、O=O键和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A. -332 B. -118
C. +350 D. +130
难度: 中等查看答案及解析
-
常温下,0.01mol·L-1MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)===M2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. +33.1 kJ·mol-1 B. +45.2 kJ·mol-1
C. -81.5 kJ·mol-1 D. -33.1 kJ·mol-1
难度: 中等查看答案及解析
 CO(g)+3H2(g)
CO(g)+3H2(g)