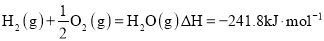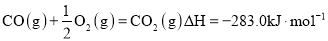-
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料,而氢气、二甲醚等都是很有发展前景的新能源。
(1)在25℃、101kPa时,1gCH4完全燃烧生成液态水时放出的热量是55.64 kJ,则表示甲烷燃烧热的热化学方程式是___________________________________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ· mol-1,已知CO气体燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-565.14 kJ·mol-1,试计算相同物质的量的C3H8和CO燃烧产生的热量的比值________(保留小数点后一位)。
(3)氢气既能与氮气发生反应又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1
3H2(g)+N2(g) 2NH3(g) ΔH=-92.4 kJ· mol-1
2NH3(g) ΔH=-92.4 kJ· mol-1
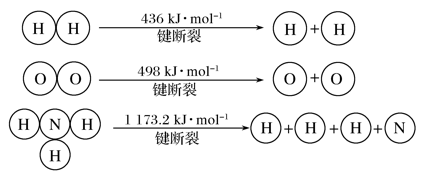
计算断裂1 mol N≡N键需要消耗能量________kJ。
(4)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+2H2(g)===CH3OH(g) ΔH1=-90.1 kJ· mol-1
②CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH2=-49.0 kJ· mol-1
水煤气变换反应:③CO(g)+H2O(g)===CO2(g)+H2(g) ΔH3=-41.1 kJ· mol
二甲醚合成反应:④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ· mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_______________________。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:_________________________________________________。
-
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式是 。
(2)已知:C(s)+ O2(g) CO2(g) ΔH=-437.3 kJ•mol-1
CO2(g) ΔH=-437.3 kJ•mol-1
H2(g)+  O2(g)
O2(g) H2O(g) ΔH=-285.8 kJ•mol-1
H2O(g) ΔH=-285.8 kJ•mol-1
CO(g)+  O2(g)
O2(g) CO2(g) ΔH=-283.0 kJ•mol-1
CO2(g) ΔH=-283.0 kJ•mol-1
则煤的气化主要反应的热化学方程式是
C(s)+ H2O(g) CO(g)+ H2(g) ΔH= kJ•mol-1。
CO(g)+ H2(g) ΔH= kJ•mol-1。
-
(20分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。(1) 在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2) 已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=_____________。
(3) 高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
① 温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
② 1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应是否处于化学平衡状态____________(填“是”或“否”),其判断依据是______
____________________________________________________________。
(4) 如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。

① 甲装置中气体A为________(填“CH4”或“O2和CO2”),d极上的电极反应式为
_____________________________________。
② 乙装置中a极上的电极反应式为__________________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③ 如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为__________________________(用含w、a的表达式表示,不必化简)。
-
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)在25℃、101kPa时,16gCH4完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式为 .
(2)已知:C(s)+O2(g)═CO2(g);△H=﹣437.3 kJ•mol﹣1
H2(g)+O2(g)═H2O(g);△H=﹣285.8 kJ•mol﹣1
CO(g)+O2(g)═CO2(g);△H=﹣283.0 kJ•mol﹣1
则煤气化反应C(s)+H2O(g)═CO(g)+H2(g) 的焓变△H= kJ•mol﹣1.
(3)如图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200mL.
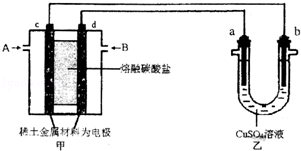
①装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为 .
②乙装置中a极上的电极反应式为 .若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4 mL(标准状况),乙装置中所得溶液的pH= .(忽略电解前后溶液体秋变化)
③如果乙中电极不变,将溶液换成饱和Na2SO3溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4•10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为 (用含w、a的表达式表示,不必化简).
-
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知: 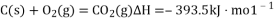
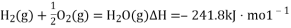

则煤气化主要反应 ________________
________________
(2)已知 的正反应速率为
的正反应速率为 ,逆反应速率为
,逆反应速率为 ,k为速率常数。2500K时,
,k为速率常数。2500K时,  ,则该温度下的反应平衡常数K=_________________ 。
,则该温度下的反应平衡常数K=_________________ 。
(3)甲醇制甲醚的有关反应为:  一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol |
| CH3OH | CH3OCH3 | H2O |
| I | 387 | 0. 20 | x | |
| II | 387 | 0. 40 | | y |
| Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
 ________________.
________________.
②已知 时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol
时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol  ,则反应将向_________(填“正”或“逆”)反应方向进行。
,则反应将向_________(填“正”或“逆”)反应方向进行。
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为______________(填序号)
A.升高温度 B.其他条件不变,增加 的物质的量
的物质的量
C.降低温度 D.保持其他条件不变,通入氖气
(4)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中 及
及 的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:
的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:
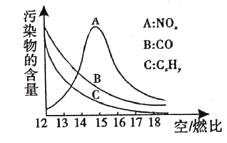
①当空/燃比达到15后 减少的原因可能是__________(填字母)。
减少的原因可能是__________(填字母)。
a.反应 是吸热反应
是吸热反应
b.当空/燃比大干15后,燃油气燃烧放出的热量相应减少
②随空/燃比增大,CO和 的含量减少的原因是______。
的含量减少的原因是______。
-
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知: 
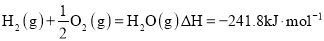
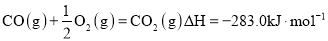
则煤气化主要反应 ________________
________________
(2)已知 的正反应速率为
的正反应速率为 ,逆反应速率为
,逆反应速率为 ,k为速率常数。2500K时,
,k为速率常数。2500K时,  ,则该温度下的反应平衡常数K=_________________ 。
,则该温度下的反应平衡常数K=_________________ 。
(3)甲醇制甲醚的有关反应为:  一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol |
| CH3OH | CH3OCH3 | H2O |
| I | 387 | 0. 20 | x | |
| II | 387 | 0. 40 | | y |
| Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
 ________________.
________________.
②已知 时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol
时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol  ,则反应将向_________(填“正”或“逆”)反应方向进行。
,则反应将向_________(填“正”或“逆”)反应方向进行。
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为______________(填序号)
A.升高温度 B.其他条件不变,增加 的物质的量
的物质的量
C.降低温度 D.保持其他条件不变,通入氖气
(4)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中 及
及 的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:
的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:

①当空/燃比达到15后 减少的原因可能是__________(填字母)。
减少的原因可能是__________(填字母)。
a.反应 是吸热反应
是吸热反应
b.当空/燃比大干15后,燃油气燃烧放出的热量相应减少
②随空/燃比增大,CO和 的含量减少的原因是______。
的含量减少的原因是______。
-
(15分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2)已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=________kJ·mol-1。
(3)如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
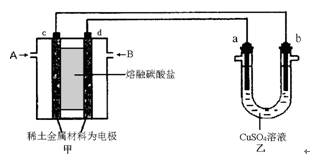
①甲装置中气体A为________(填“CH4”或“O2和CO2”),d极上的电极反应式为_____________。
②乙装置中a极上的电极反应式为____________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为________(用含w、a的表达式表示,不必化简)。
-
能量是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知:C(s)+O2(g)=CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)=H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)=CO(g)+H2(g)的焓变ΔH=________kJ·mol-1。
(2)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作电解质。向负极充入燃料气CH4,用空气与 CO2 的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中, CO32-移向_________极(填“正”或“负”) ,已知 CH4 发生的电极反应式为 CH4 + 4CO32-―8e-= 5CO2+2H2O,则另一极的电极反应方程式为:
(3)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D 均为铂电极,
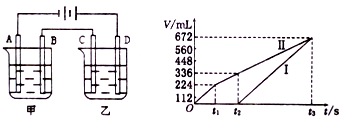
A.甲槽中有200ml一定浓度的NaCl与C uSO4混合溶液,理论上两极所得气体的体积随时间变化的关系入上图所示(气体体积已换算成标准状况下的体积),(电解前后溶液的体积变化关系忽略不计)
①原混合溶液NaCl的物质的量浓度 mol/L, CuSO4的物质的量浓度 mol/L。
②t2时所得溶液的pH=___________
B.乙槽CuSO4 溶液200ml。乙槽内电解的总化学方程式________________;
①当 C 极析出 0.64g 物质时,乙杯溶液中生成的硫酸为_________mol。电解后,若使乙池内的溶液完全复原,可向乙池中加入_____________(选填字母标号)
A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3
②若通电一段时间后,向所得的乙杯溶液中加入 0.2mol 的 Cu(OH)2 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为______________。
-
氢气既是一种清洁能源,又是一种化工原料,在国民经济中发挥着重要的作用。
(1)氢气是制备二甲醚的原料之一,可通过以下途径制取:
Ⅰ.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H
Ⅱ.2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) △H
已知:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=akJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2=bkJ•mol-1
③CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H3=ckJ•mol-1
则反应Ⅱ的△H____kJ•mol-1
(2)氢气也可以和CO2在催化剂(如Cu/ZnO)作用下直接生成CH3OH,方程式如下CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),现将1molCO2(g)和3molH2(g)充入2L刚性容器中发生反应,相同时间段内测得CH3OH的体积分数φ (CH3OH)与温度(T)的关系如图所示:
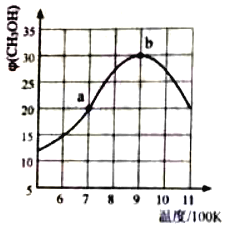
①经过10min达到a点,此时CH3OH的体积分数为20%.则v(H2)=___(保留三位小数)。
②b点时,CH3OH的体积分数最大的原因是___。
③b点时,容器内平衡压强为 P0,CH3OH的体积分数为30%,则反应的平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×体积分数)
④a点和b点的v逆,a__b(填“>”“<”或”=”)若在900K时,向此刚性容器中再充入等物质的量的CH3OH和H2O,达平衡后φ(CH3OH)___30%。
⑤在900K及以后,下列措施能提高甲醇产率的是____(填字母)
a.充入氦气 b.分离出H2O c.升温 d.改变催化剂
(3)H2还可以还原NO消除污染,反应为2NO(g)+2H2(g)⇌N2(g)+2H2O(g),该反应速率表达式v=k•c2(NO)•c(H2)(k是速率常数,只与温度有关),上述反应分两步进行:
i.2NO(g)+H2(g)⇌N2(g)+H2O2(g)△H1;ii.H2O2(g)+H2(g)⇌2H2O(g)△H2化学总反应分多步进行,反应较慢的一步控制总反应速率,上述两步反应中,正反应的活化能较低的是___(填“i”或“ii”)
-
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“=” );

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。
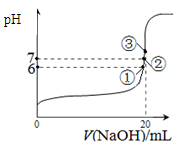
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为 。
2NH3(g) ΔH=-92.4 kJ· mol-1



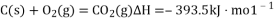
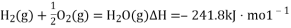

 ________________
________________ 的正反应速率为
的正反应速率为 ,则该温度下的反应平衡常数K=_________________ 。
,则该温度下的反应平衡常数K=_________________ 。 一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。 ,则反应将向_________(填“正”或“逆”)反应方向进行。
,则反应将向_________(填“正”或“逆”)反应方向进行。
 是吸热反应
是吸热反应