-
分子式为C7H14O2的有机物在酸性条件下可水解为酸和醇,且生成的醇无具有相同官能团的同分异构体。若不考虑立体异构,这些酸和醇重新组合可形成的酯共有
A. 8种 B. 16种 C. 24种 D. 28种
难度: 困难查看答案及解析
-
日常生活中硫、氮氧化物的排放可能导致“酸雨”。下列活动会导致“酸雨”危害加剧的是( )
A.种草植树,建设“海绵”城市 B.推广使用电动车
C.普及燃煤供暖,减少石油依赖 D.开发太阳能照明
难度: 简单查看答案及解析
-
我国的“长三丙火箭”第三级推进器使用的燃料是液态氢。已知在25 C时,2 g H2在O2中完全燃烧生成液态水时放出热量285.8 kJ。下列有关说法中,正确的是
A. H2的燃烧热为–285.8 kJ
B. 2H2(g) + O2(g) = 2H2O(l) H = –571.6 kJ·mol–1
C. 25 C时,2H2(g) + O2(g) = 2H2O(g)的H –571.6 kJ·mol–1
D. 25 C时,11.2 L H2在O2中完全燃烧生成液态水时放出热量142.9 kJ
难度: 中等查看答案及解析
-
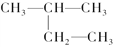
下列各化合物的命名中正确的是
A. CH2
CH—CH
CH2 1,3-二丁烯 B.
 3-丁醇
3-丁醇C.
甲基苯酚 D.
 2-甲基丁烷
2-甲基丁烷难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是
A. 含有大量ClO-的溶液:Na+、OH-、I-、SO32-
B. 使pH试纸变蓝的溶液:NH4+、K+、S2-、CO32-
C. 澄清透明的溶液:Cu2+、Fe3+、NO3-、Cl-
D. c(Al3+)=0.1mol/L的溶液:Na+、Cl-、CO32-、NO3-
难度: 中等查看答案及解析
-
4去甲基表鬼臼毒素具有抗肿瘤等作用,分子结构如图所示,分子中含有的含氧官能团有
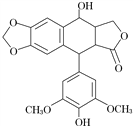
A. 2种 B. 3种 C. 6种 D. 5种
难度: 简单查看答案及解析
-
下列物质的转化在给定条件下能实现的是

A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
难度: 中等查看答案及解析
-
利用下图所示装置可以模拟铁的电化学腐蚀。下列说法中,正确的是
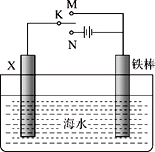
A. 若X为碳棒,开关K置于M处可以减缓铁的腐蚀
B. 若X为铜棒,开关K置于N处可以加快铁的腐蚀
C. 若X为碳棒,开关K置于M处,则为牺牲阳极的阴极保护法
D. 若X为碳棒,开关K置于N处,则为外加电流的阴极保护法
难度: 中等查看答案及解析
-
下列有关氨或铵盐的说法不正确的是
A. NH3属于弱电解质
B. 可用湿润的红色石蕊试纸检验氨气
C. 用盐酸滴定氨水,当溶液呈中性时,c(NH4+) = c(Cl-)
D. 常温时,0.1mol·L-1NH4Cl溶液加水稀释,
 的值不变
的值不变难度: 中等查看答案及解析
-
用Cl2生产某些含氯有机物时会产生副产物HCl。利用如下反应,可实现氯的循环利用:4HCl(g)+O2(g)
2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
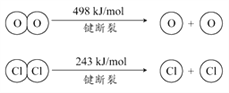
下列说法正确的是
A. 升高温度能提高HCl的转化率
B. 加入催化剂,能使该反运的焓变减小
C. 1molCl2转化为2molCl2原子放出243kJ热量
D. 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高
难度: 中等查看答案及解析
-
298K下,一些银盐的溶度积见下表。
化学式
Ag2SO4
Ag2S
AgCl
AgBr
AgI
KSP
1.2×10-5
6.7×10-50
1.8×10-10
5.0×10-13
8.9×10-17
下列说法中,错误的是
A. 五种银盐中,常温下溶解度最大的是Ag2SO4
B. 向饱和AgCl溶液中加入0.1mol/LNa2S溶液后,有黑色沉淀生成
C. 常温下,饱和卤化银溶液中c(Ag+)大小顺序为:AgCl <AgBr<AgI
D. 将0.02mol/LAgNO3溶液与0.02mol/LNa2SO4溶液等体积混合后,无沉淀生成
难度: 困难查看答案及解析
-
氢核磁共振谱是根据分子中不同化学环境的氢原子在谱图中给出的信号峰不同来确定分子中氢原子种类的。在下列6种有机分子中,氢核磁共振谱中给出的信号峰数目相同的一组是
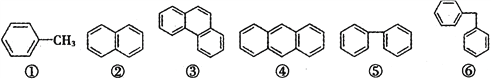
A. ①⑤ B. ②④ C. ④⑤ D. ⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是
A. 水库的钢闸门接直流电源的正极,可以减缓闸门的腐蚀
B. 加入少量硫酸铜可加快锌与稀硫酸的反应速率,说明Cu2+具有催化作用
C. H2O2分解产生标准状况下22.4 L O2,理论上转移电子数约为4×6.02×1023
D. 常温下pH=3的盐酸与pH=11的某碱溶液等体积混合,若溶液呈碱性,该碱为弱碱
难度: 中等查看答案及解析
-
通过以下反应均可获取CO。下列有关说法正确的是
①木炭不完全燃烧制CO:2C(s)+O2(g)=2CO(g) ΔH1=-221kJ·mol-1
②木炭还原CO2制CO:C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
③焦炭还原Fe2O3制CO:Fe2O3(s) + 3C(s)
2Fe(s) + 3CO(g) ΔH 3=+489.0kJ·mol-1
A. 反应①中化学能全部转化为热能
B. 反应②为吸热反应,在任何情况下都不能自发进行
C. 反应③中使用催化剂或移走部分CO,均可提高Fe2O3的转化率
D. 反应Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) ΔH =-28.5 kJ·mol-1
难度: 简单查看答案及解析
-
下列各图示与对应的描述相符合的是
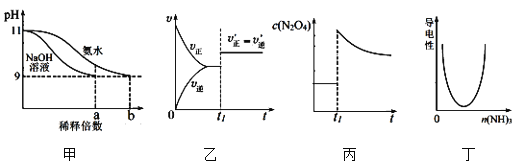
A. 图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100
B. 图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂
C. 图丙表示平衡2NO2(g)
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D. 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
难度: 困难查看答案及解析
-
电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能。“金属(M)〜空气电池”(如下图)具有原料易得、能量密度高等优点。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。下列说法不正确的是
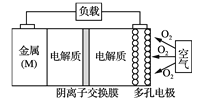
A. “金属(M)〜空气电池”放电过程的正极反应式: O2+2H2O+4e-=4OH-
B. 比较Mg、Al、Zn三种“金属—空气电池”,“Al—空气电池”的理论比能量最高
C. 电解质溶液中的阴离子从负极区移向正极区
D. 在“M—空气电池”中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系正确的是
A. 常温下,将0.1mol·L-1NH4CI溶液与0.05mol·L-1NaOH溶液等体积混合:c(C1-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
B. 在小苏打溶液中存在:c(HCO3-)=c(Na+)-c(CO32-)-c(H2CO3)
C. 向CH3COOH溶液中加入适量的NaOH,得到pH=4的混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. pH=3的一元酸HX和PH=11的一元碱MOH等体积混合:c(M+)=c(X-)>c(H+)=c(OH-)
难度: 困难查看答案及解析
-
下列说法正确的是
A. 实验室用Zn和稀硫酸制H2,为加快反应速率,可向稀硫酸中加入少量Cu粉
B. CH3Cl(g)+Cl2(g)
CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的ΔH>0
C. 在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g)
PCl5(g),压缩体积,平衡正向移动,K值增大
D. 25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,若该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)<c(NaCN)
难度: 中等查看答案及解析
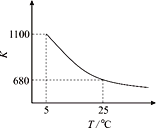
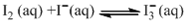 。该反应的平衡常数K随温度变化规律如图所示。下列说法中,正确的是
。该反应的平衡常数K随温度变化规律如图所示。下列说法中,正确的是