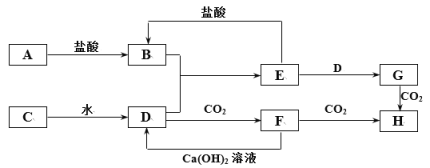
-
有① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是
A. 3种溶液pH的大小顺序是③>②>①
B. 若将3种溶液稀释相同倍数,pH变化最大的是②
C. 若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D. 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
难度: 中等查看答案及解析
-
已知反应2CO(g)===2C(s)+O2(g)的ΔH为正值,ΔS为负值。设ΔH和ΔS不随温度而变,下列说法正确的是
A. 低温下能自发进行
B. 高温下能自发进行
C. 低温下不能自发进行,高温下能自发进行
D. 任何温度下都不能自发进行
难度: 中等查看答案及解析
-
为了测定酸碱反应的中和反应反应热,计算时至少需要的数据是( )
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
A. ①②③⑥ B. ①③④⑥ C. ③④⑤⑥ D. 全部
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.中和热测定实验用的小烧杯和物质的量浓度溶液配制用的容量瓶都必须干燥
B.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液终点时仰视读数,氢氧化钠浓度偏低
C.配制2.0 mol·L-1的硫酸,若定容时俯视,则所得溶液浓度偏高(其他操作均正确)
D.用铜电极电解2.0 mol·L-1的硫酸,阴阳两极生成气体的体积之比为2∶1
难度: 中等查看答案及解析
-
下列离子或分子组中,在相应的环境中能大量共存的是( )
选项
环境要求
离子
A
溶液中c(K+)<c(Cl-)
K+、AlO、Cl-、NO
B
溶液pH﹥7
Na+、S2-、K+、ClO-
C
水电离产生的c(H+)=10-12 mol/L的溶液
ClO-、CO
、NH、NO、SO
D
向溶液中逐滴滴加烧碱溶液先有沉淀产生,后沉淀消失
Na+、Al3+、Cl-、SO
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质中,属于溶于水后能导电的非电解质的是( )
A. SO3 B. 乙醇 C. CaO D. 醋酸
难度: 简单查看答案及解析
-
已知X、Y、Z、W是原子序数依次递增的同主族元素,下列常见的阴离子能影响水的电离平衡的是( )
A. X- B. Y- C. Z- D. W-
难度: 中等查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充入O2
难度: 中等查看答案及解析
-
在某容积不变的密闭容器中放入一定量的NO2,发生反应2NO2(g)
N2O4(g);ΔH<0, 在达到平衡后,若分别单独改变下列条件,重新达到平衡后,能使平衡混合气体平均相对分子质量减小的是 ( )
A.通入N2 B.通入NO2 C.通入N2O4 D.降低温度
难度: 中等查看答案及解析
-
已知反应:H2S(g) + aO2(g) ===X + cH2O(l) ΔH,若ΔH表示H2S的燃烧热,则X为( )
A. S(s) B. SO2(g) C. SO3(g) D. SO3(l)
难度: 中等查看答案及解析
-
两个氢原子结合成一个氢分子时放出a kJ热量,那么标准状况下V L的H2完全分解为氢原子,需要吸收的能量约为(NA表示阿伏加德罗常数) ( )kJ
A. Va/22.4 B. VaNA/22.4 C. aNA D. Va
难度: 中等查看答案及解析
-
判断下列实验装置进行的相应实验,错误的是( )
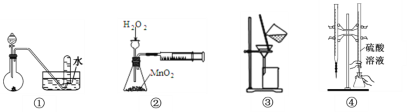
A. 用①图装置,进行H2O2分解制取少量O2的实验
B. 用②图装置,进行测定H2O2的分解速率的实验
C. 用③图装置,进行分离Fe(OH)3胶体和NaCl溶液的实验
D. 用④图装置,进行用已知浓度的硫酸溶液测定NaOH溶液浓度的实验
难度: 中等查看答案及解析
-
下列事实能说明影响化学反应速率的决定因素是反应物本身性质的是( )
A. Cu与浓硝酸反应比与稀硝酸反应快
B. Cu能与浓硝酸反应,而不能与浓盐酸反应
C. N2与O2在常温常压下不能反应,放电时可反应
D. 向H2O2溶液中,分别滴加5滴等浓度的FeCl3溶液或CuSO4溶液,前者产生气泡快
难度: 中等查看答案及解析
-
下列物质的水溶液在空气中小心加热蒸干灼烧至质量不再减少,能得到较纯净的原溶质的是( )
①CuSO4 ②FeSO4 ③K2CO3 ④Ca(HCO3)2 ⑤NH4HCO3 ⑥KMnO4 ⑦FeCl3
A. 全部都可以 B. 仅③ C. 仅①③ D. 仅①③⑥
难度: 中等查看答案及解析
-
如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,
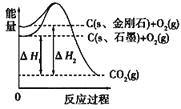
下列说法或表示式正确的是
A. 石墨和金刚石的转化是物理变化
B. C(s、石墨)===C(s、金刚石)ΔH =+1.9kJ·mol-1
C. 金刚石的稳定性强于石墨
D. 断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
zC(g),达到平衡时,测得A的浓度为0.5 mol/L,在温度不变的条件下,将容器的体积扩大到两倍,使再达到平衡,测的A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A. x+y<z B. 平衡向正反应方向移动
C. C的体积分数下降 D. B的浓度增大
难度: 困难查看答案及解析
-
下列离子方程式错误的是
A. FeSO4酸性溶液暴露在空气中:4Fe2+ +O2 +4H+ = 4Fe3+ +2H2O
B. 为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3-+H+ = H2O+CO2↑
C. 明矾净水的原理:Al3++3H2O = Al(OH)3(胶体)+3H+
D. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2+ + Al3+ + 2SO42-+ 4OH- = AlO2-+2BaSO4↓+2H2O
难度: 中等查看答案及解析
-
为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是( )
A. 配制0.10 mol/L CH3COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B. 用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1,则可证明醋酸是弱电解质
C. 取等体积等浓度的盐酸和醋酸溶液,分别加入足量的Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质
D. 配制0.10 mol/L CH3COONa溶液,测其pH,若常温下pH>7,则可证明醋酸是弱电解质
难度: 中等查看答案及解析
-
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量
A. ②③⑤ B. ①②③ C. ②③④ D. ①③④⑤
难度: 简单查看答案及解析
-
常温下0.1 mol/L氨水的pH=a,下列能使溶液的pH=(a-1)的措施是( )
A. 将溶液稀释到原体积的10倍 B. 加入适量的氯化铵固体
C. 加入等体积0.2 mol/LNaOH溶液 D. 提高溶液的温度(不考虑挥发)
难度: 中等查看答案及解析
-
可逆反应H2(g)+I2(g)
2HI(g)
H<0 达到平衡后,当改变外界条件如物质浓度、体系压强、温度等而发生下列项目的变化时,能作为平衡一定发生了移动的标志的是
A. 气体的密度变小了 B. 反应物和生成物浓度均变为原来的2倍
C. 气体的颜色变深了 D. 体系的温度发生了变化
难度: 困难查看答案及解析
-
一定条件下,将10 mol H2和1 mol N2充入一密闭容器中,发生反应:N2(g)+3H2(g)
2NH3(g),达到平衡时,H2的转化率可能是
A. 25% B. 30% C. 35% D. 75%
难度: 中等查看答案及解析
-
某温度时,反应SO2(g)+1/2O2(g)
SO3(g)的平衡常数K=50。在同一温度下,反应2SO3(g)
2SO2 (g)+O2(g)的平衡常数K1应为( )
A. 2 500 B. 100 C. 4×10-4 D. 2×10-2
难度: 中等查看答案及解析
-
常温条件下,下列各组比值为1∶2的是( )
A. 0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比
B. 0.1 mol/L与0.2 mol/L 醋酸溶液,c(H+)之比
C. pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比
D. pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
难度: 中等查看答案及解析
-
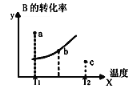
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)
2HBr(g) ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如下图所示。下列说法正确的是
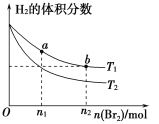
A. 由图可知:T1<T2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法
D. T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
难度: 中等查看答案及解析
-
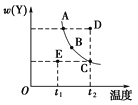
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 2B(g)
xC(g)ΔH=-192kJ·mol-1。向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
难度: 中等查看答案及解析
-
25℃时,将1 mol NH4NO3溶于水,再向该溶液滴加b L氨水后溶液呈中性,据此判断下列说法中不正确的是(NH3·H2O的电离平衡常数取Kb=2×10-5)
A. 水的电离先受到促进,后受到抑制,最终水电离的c(OH-)=
B. 滴加b L氨水后的溶液中,n(NH4+)=200n(NH3·H2O)=1 mol
C. 所滴加氨水的浓度为0.005/b mol/L
D. 滴加b L氨水后的溶液中各离子浓度大小是:c(NH4+)=c(NO3-)>c(H+)=c(OH-)
难度: 中等查看答案及解析
-
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。
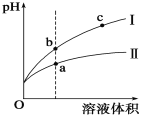
据图判断正确的是
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点酸的总浓度大于a点酸的总浓度
C.a点Kw的数值比c点Kw的数值大
D.b点溶液的导电性比c点溶液的导电性强
难度: 中等查看答案及解析
-
在0.1 mol/L的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是
A. 水;c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B. 0.1 mol/L盐酸;c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
C. 0.1 mol/L醋酸;c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. 0.1 mol/L氢氧化钠;c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
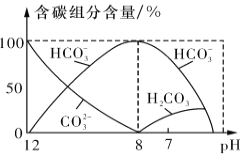
根据表中数据,下列判断正确的是( )

A. 在等浓度的NaF、NaH2PO4混合溶液中:c(Na+) + c(H+)=c(F-) + c(H2PO4-) + c(OH-)
B. 少量H3PO4和NaF反应的离子方程式为:H3PO4 +2F-===HPO42-+2HF
C. 同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4
D. 结合质子能力:PO43->HPO42->F-
难度: 中等查看答案及解析
-
已知:H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8;H2CO3的Ka1=4.2×10-7,Ka 2=5.6×10-11。现将标准状况下2.24L的CO2和2.24L的SO2分别通入两份150mL1mol/LNaOH溶液中,关于两溶液的比较下列说法正确的是
A. c(HCO3-)<c(CO32-)
B. 两溶液都能使酸性高锰酸钾溶液褪色
C. c(HCO3-)>c(HSO3-)
D. c(CO32-)+c(HCO3-)=c(SO32-)+c(HSO3-)
难度: 中等查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是( )
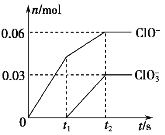
A. 苛性钾溶液中KOH的物质的量是0.09 mol
B. ClO的生成是由于氯气的量的多少引起的
C. 在酸性条件下ClO-和ClO可生成Cl2
D. 反应中转移电子的物质的量是0.21 mol
难度: 简单查看答案及解析
-
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是
A. 铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI
CeI4+ 2H2↑
B. 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+=Ce3++ 2Fe3+
C. 在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D. 铈的四种核素
、
、
、
,它们互称为同素异形体
难度: 中等查看答案及解析