-
(每空2分,共10分)绿矾(FeSO4·7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O===(NH4)2SO4·FeSO4·6H2O↓。其流程可表示为:
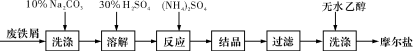
(1)洗涤中Na2CO3的主要作用是_____________。
(2)结晶过程中需要加热蒸发溶剂,加热到_____________(填字母)时,停止加热,冷却结晶。
A.沸腾 B.液体表面出现晶膜
C.析出少量晶体 D.快蒸干,还有少量液体
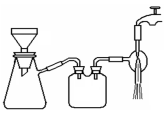
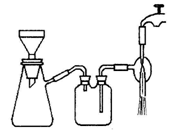
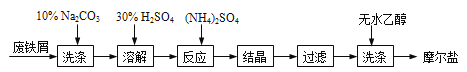
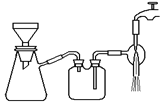
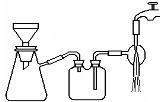
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,过滤速度较快的原因是___。
(4)用无水乙醇洗涤的目的是①___________,②__________。
-
绿矾( FeSO4·7H2O )、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为: (NH4)2 SO4 + FeSO4 + 6H2O =(NH4)2SO4·FeSO4·6H2O↓。其流程可表示为:
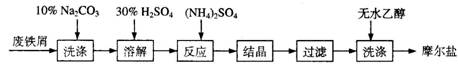
(1)洗涤中Na2CO3的主要作用是________。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到________时,停止加热。
(3)过滤是用下图所示装置进行的,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是________。
(4)用无水乙醇洗涤的目的是________。
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液10.00mL。
①本实验的指示剂是________。(填字母)
A. 酚酞 B.甲基橙C.石蕊D.不需要
②产品中Fe2+的质量分数为________。
-
绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓。其流程可表示为:
(1)洗涤中Na2CO3的主要作用是 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到 时,停止加热。
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是 。
(4)用无水乙醇洗涤的目的是 。
(5)产品中Fe2+的定量制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol·L-1KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①本实验的指示剂是 。
②产品中Fe2+的质量分数为 。
-
绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓。其流程可表示为:

(1)洗涤中Na2CO3的主要作用是 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到 时,停止加热。
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是 。
(4)用无水乙醇洗涤的目的是 。
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①本实验的指示剂是 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
②产品中Fe2+的质量分数为 。
-
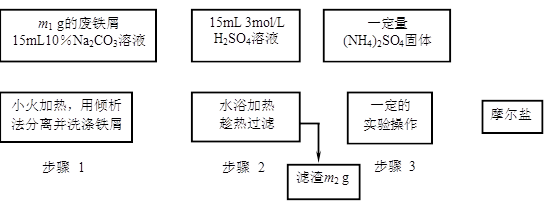
已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定.以下是将绿矾、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图.根据下图回答:
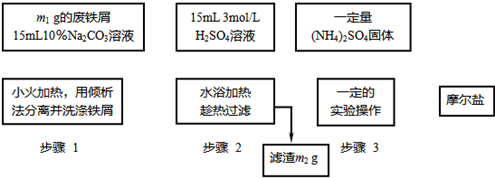
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:______.
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有______:
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示):______.步骤2中溶液趁热过滤的原因是______.
(4)步骤3中,加入(NH4)2SO4固体后,应加热到______时,停止加热.需经过的实验操作包括:______、______、减压过滤(或抽滤)等得到较为______的晶体.
(5)抽滤装置的仪器有:______、______、安全瓶、抽气泵组成.
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+.为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法.
称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2mo1/L KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00mL.
①请完成滴定过程中发生的离子方程式:
______Fe2++______MnO4-+______=______Mn2++______Fe3++______H2O
②本实验的指示剂______.
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于______(酸式、碱式)滴定管中
④终点颜色的变化:______.
⑤产品中Fe2+的质量分数为______.
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:______.(用a,b,c回答)
-
(16分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。
以下是将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答:
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:▲ 。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有▲ :
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是▲ 。
(4)步骤3中,加入(NH4)2SO4固体后,应加热到▲时,停止加热。需经过的实验操作包括:▲ 、 ▲ 、减压过滤(或抽滤)等得到较为▲ 的晶体。
(5)抽滤装置的仪器有:▲ 、▲ 、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
________Fe2+ +________MnO4-+( )= ________Mn2+ + ________Fe3+ + ________H2O
②本实验的指示剂▲ 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于▲ (酸式、碱式)滴定管中
④终点颜色的变化:▲ 。
⑤产品中Fe2+的质量分数为▲ 。
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:▲ 。(用a,b,c回答)
-
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑
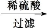 溶液A
溶液A

 莫尔盐
莫尔盐
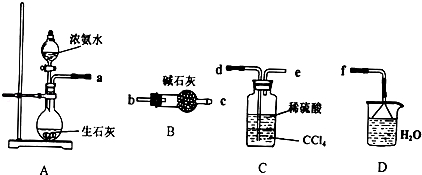
(1)向废铁屑中加入稀硫酸后,不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是 ;证明溶液A不含Fe3+的最佳试剂是 (填序号字母)。
A.酚酞溶液 B.KSCN溶液
C.烧碱溶液 D.KMnO4溶液
操作Ⅰ的步骤是:加热蒸发、 、过滤。
(2)操作Ⅰ得到的莫尔盐晶体用少量乙醇淋洗,其目的是:①除去晶体表面附着的硫酸、水等杂质;② 。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平 (填“左”或“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接 ; 接 。
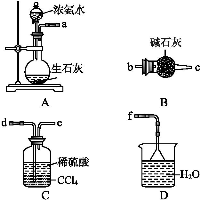
将装置C中两种液体分离开的操作名称是 。装置D的作用是 。
-
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑
 溶液A
溶液A

 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是___;证明溶液A不含Fe3+的最佳试剂是___(填序号字母)。
A 酚酞溶液 B KSCN溶液
C 烧碱溶液 D KMnO4溶液
操作Ⅰ的步骤是:加热蒸发、___、过滤。
(2)操作Ⅰ得到的莫尔盐晶体用少量乙醇淋洗,其目的是:①除去晶体表面附着的硫酸、水等杂质②______。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平___(填“左”或“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接___;__接___。
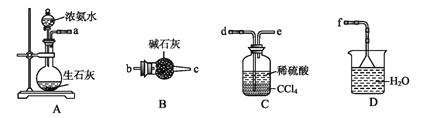
将装置C中两种液体分离开的操作名称是____。装置D的作用是__。
-
浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4•FeSO4•6H2O]比绿矾(FeSO4•7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:
废铁屑
 溶液A
溶液A

 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是 ;证明溶液A不含Fe3+离子的最佳试剂是 (填序号字母).
a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、 、过滤.
(2)将莫尔盐晶体放在托盘天平左盘进行称量时,天平指针向右偏转,说明 .
(3)为了测定所得莫尔盐中Fe2+的含量,称取4.0g莫尔盐样品,溶于水配成溶液并加入稀硫酸,用0.2mol/L的KMnO4溶液进行滴定,到滴定终点时,消耗了KMnO4溶液10.00mL.则样品中Fe2+的质量分数为 (已知反应中MnO4﹣变为Mn2+).
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接 ; 接 .将装置C中两种液体分离开的操作名称是 .装置D的作用是 .
-
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4·(NH4)2SO4·6H2O。硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了。硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得。下图是模拟工业制备硫酸亚铁铵晶体的实验装置。回答下列问题:
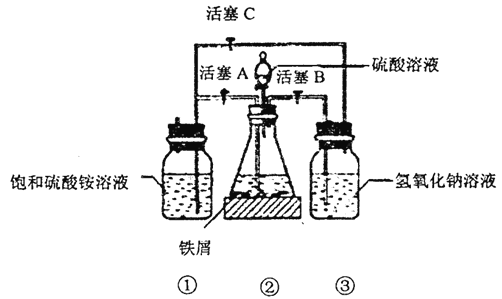
I.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS 等),再用清水洗净。用氢氧化钠溶液煮沸的目的是__________________。
(2)将处理好的铁屑放入锥形瓶中,加入稀硫酸。锥形瓶中发生反应的离子方程式可能为________(填序号)。
A.Fe+2H+==Fe2++H2↑ B.Fe2O3+5H+===2Fe3++3H2O
C.2Fe3++S2-==2Fe2++S↓ D.2Fe3++Fe==3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞_______,打开活塞______(填字母)。容器③中NaOH溶液的作用是___________;向容器①中通入氢气的目的是___________。
I.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部。在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。制得的硫酸亚铁铵晶体中往往含有极少量的Fe2+。为测定晶体中Fe2+的含量,称取一份质量为20.0g 的硫酸亚铁铵晶体样品,制成溶液。用0.5 mol/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO4- 被还原成Mn2+时,耗KMnO4 溶液体积20.00mL。
滴定时,将KMnO4 溶液装在____(酸式或碱式) 滴定管中,判断反应到达滴定终点的现象为____;晶体中FeSO4的质量分数为____________。










 溶液A
溶液A



