-
(16分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。
以下是将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答:
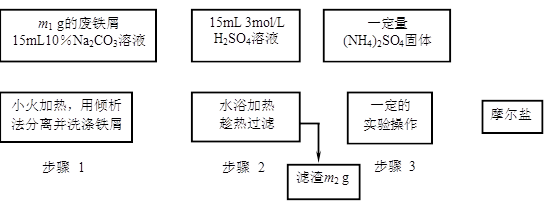
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:▲ 。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有▲ :
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是▲ 。
(4)步骤3中,加入(NH4)2SO4固体后,应加热到▲时,停止加热。需经过的实验操作包括:▲ 、 ▲ 、减压过滤(或抽滤)等得到较为▲ 的晶体。
(5)抽滤装置的仪器有:▲ 、▲ 、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
________Fe2+ +________MnO4-+( )= ________Mn2+ + ________Fe3+ + ________H2O
②本实验的指示剂▲ 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于▲ (酸式、碱式)滴定管中
④终点颜色的变化:▲ 。
⑤产品中Fe2+的质量分数为▲ 。
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:▲ 。(用a,b,c回答)
-
已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定.以下是将绿矾、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图.根据下图回答:
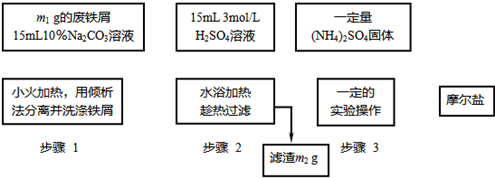
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:______.
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有______:
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示):______.步骤2中溶液趁热过滤的原因是______.
(4)步骤3中,加入(NH4)2SO4固体后,应加热到______时,停止加热.需经过的实验操作包括:______、______、减压过滤(或抽滤)等得到较为______的晶体.
(5)抽滤装置的仪器有:______、______、安全瓶、抽气泵组成.
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+.为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法.
称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2mo1/L KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00mL.
①请完成滴定过程中发生的离子方程式:
______Fe2++______MnO4-+______=______Mn2++______Fe3++______H2O
②本实验的指示剂______.
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于______(酸式、碱式)滴定管中
④终点颜色的变化:______.
⑤产品中Fe2+的质量分数为______.
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:______.(用a,b,c回答)
-
硫酸亚铁铵[ (NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
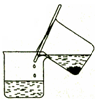
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用下所示方法分离出固体并洗涤、干燥。
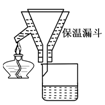
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图所示),收集滤液和洗涤液。
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图13分离方法称为________法。
(2)步骤2中有一处明显不合理的是________。趁热过滤的理由是________。
(3)步骤3加热浓缩过程中,当________时停止加热。用无水乙醇洗涤晶体的原因是________。
(4)FeSO4·7H2O在潮湿的空气中易被氧化成Fe(OH)SO4·3H2O,写出该反应的化学方程式________。
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:

图1
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·
L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
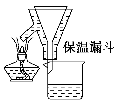
图2
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图1分离方法称为________法。
(2)步骤2中有一处明显不合理的是___________________________________。
趁热过滤的理由是________________________________________________。
(3)步骤3加热浓缩过程中,当________时停止加热。用无水乙醇洗涤晶体的原因是______________________________________________________________。
(4)FeSO4·7H2O在潮湿的空气中易被氧化成Fe(OH)SO4·3H2O,写出该反应的化学方程式________________________________________________________。
-
硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O是一种浅绿色晶体,在水中的溶解度较小,不溶于乙醇。某实验小组利用镀锌铁片来制备硫酸亚铁铵的过程如下:

(1)加入盐酸是为了除去锌镀层,判断锌镀层已被除去的现象是________。
(2)A物质可以是________(选填序号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是________。
(3)操作Ⅱ的名称为________。
(4)采用晾干而不用加热烘干晶体的原因是________。
(5)工业上常用K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72—被还原成Cr3+。
写出硫酸亚铁铵溶液与酸性K2Cr2O7溶液反应的离子方程式________。
-
摩尔盐[(NH4)2SO4•FeSO4•6H2O]是一种复盐,它易溶于水,不溶于乙醇,性质比一般亚铁盐稳定,不易被氧化.某实验小组查得硫酸铵、七水硫酸亚铁、硫酸亚铁铵的溶解度如表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
该实验小组在实验室按下列流程进行制取摩尔盐的实验:
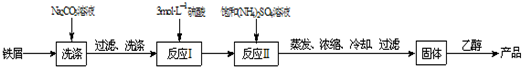
(1)洗涤的目的是除去铁屑表面的______(填物质名称),用离子方程式表示碳酸钠溶液具有洗涤上述作用的原因______
(2)反应Ⅰ为了加快铁屑(过量)的溶解,除了加热外,还可加入少量的______(填物质化学式),反应后Ⅰ要“趁热过滤”,其目的是:______.
(3)蒸发浓缩前溶液中加入少量稀硫酸,其作用是:______.
(4)反应Ⅱ后的溶液经蒸发等操作所得固体用乙醇洗涤的目的是:______.
(5)在摩尔盐溶液中加入足量氨水,反应的离子方程式为:______.
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
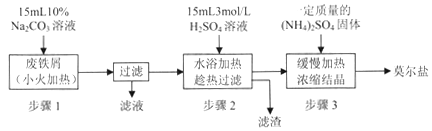
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
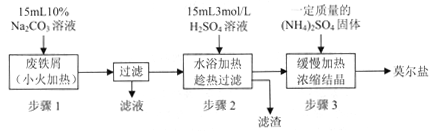
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是透明、浅蓝绿色晶体,易溶于水而不溶于酒精等有机溶剂,在空气中一般比较稳定,不易被氧化。制备步骤如下:
步骤1.称取还原铁粉0.4g,炭粉0.3g,放入50mL 锥形瓶中,加入3.5 mL2mol·L-1硫酸置于60℃ 热水浴中加热(如下左图),待反应完全,取出冷却,再加入6 mol·L-1的硫酸2 mL。
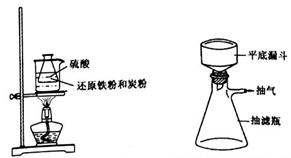
步骤2.在上述反应液中加入浓氨水0.8 mL,振荡混匀,抽滤(如上右图)。向滤液中加入10mL无水乙醇,静置,大量晶体析出,倾析,再次抽滤。
步骤3.取出晶体,用干净的滤纸吸干,称量并分析样品。
请回答下列问题:
(1)步骤1中炭粉的作用是_______,加人6 mol·L-1硫酸的作用是____________。
(2)向滤液中加人无水乙醇目的是_________________。
(3)产品中金属阳离子的检验方法及现象________________。
(4)称取获得的硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](摩尔质量为392g·mol-1)1.9600 g 配成100mL溶液,取出20.00mL滴加稀H2SO4酸化后用0 . 0100 mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液为18.00mL 。
下列有关滴定的操作正确的是_(填字母编号)。
a.滴定过程中眼睛注视滴定管中液面变化
b.滴定完成后取下滴定管握住中部防止掉落
c.读数过程中保持滴定管自然悬垂
d.读数时视线与刻度线、凹液面最低处切线相平齐
滴定过程中反应离子方程式为____________,制得硫酸亚铁钱样品的纯度为__________。
-
摩尔盐[FeSO4·(NH4)2SO4·6H2O]是一种能溶于水、难溶于酒精的浅蓝绿色晶体,常用于定量分析中配制亚铁离子的标准溶液,实验室用下图所示装置制备摩尔盐。下列说法错误的是
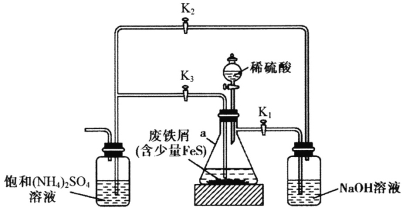
A.铁屑上的少量油污可用煮沸的饱和Na2CO3溶液洗涤,再用蒸馏水洗净
B.用标准摩尔盐滴定酸性KMnO4溶液时不需要外加指示剂
C.实验开始阶段产生的气体是用来排出装置内的空气
D.实验开始时应先打开K1、K3,关闭K2;待a中反应即将完成时,再打开K2,关闭K1










