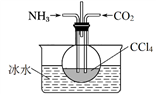
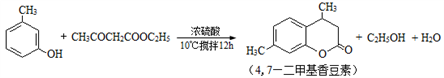
-
2017年全国环保大会在北京召开,旨在保护环境、造福人类。下列说法不正确的是
A. 用光催化分解水代替电解水制氢气,可实现节能环保
B. 用可降解塑料聚乳酸代替聚乙烯塑料,可减少白色污染
C. 用太阳能等清洁能源代替化石燃料,可节约资源、保护环境
D. 用明矾代替二氧化氯处理生活污水,可提高杀菌消毒效果
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
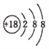
A. 中子数为18的硫原子:
S B. S2-的结构示意图:
C. 过氧化氢的电子式:H+
H+ D. 葡萄糖的结构简式:C6H12O6
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 活性炭具有还原性,可用作冰箱除味剂
B. 二氧化硫具有氧化性,可用作造纸漂白剂
C. Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
D. FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子最外层电子数是内层的2倍,Y是地壳中含量最高的元素,W的原子序数是Y的2倍,X、Y、Z、W最外层电子数之和为19。下列说法正确的是
A. X和Y只能形成一种化合物
B. 原子半径:r(Z) > r(W) > r(Y)
C. W的简单气态氢化物的热稳定性比Y强
D. 元素Z、W的简单离子具有相同的电子层结构
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是
A. Cl2通入水中:Cl2 + H2O
2H+ + Cl-+ClO-
B. 将铜丝插入浓硝酸中:3Cu + 8H+ + 2NO3- ═ 3Cu2+ + 2NO ↑+ 4H2O
C. 将过氧化钠投入足量水中:2Na2O2 + 2H2O ═ 4Na+ + 4OH-+ O2 ↑
D. (NH4)2Fe(SO4)2溶液与过量Ba(OH)2溶液混合:Fe2+ + 2SO
+ 2Ba2+ + 2OH- ═ Fe(OH)2 ↓ + 2BaSO4 ↓
难度: 困难查看答案及解析
-
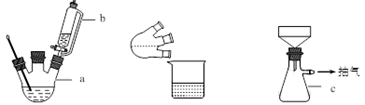
实验室用KClO3在MnO2催化下受热分解制取少量O2,并回收KCl,下列装置不能达实验目的的是
A. 制取氧气
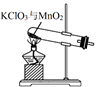 B. 收集氧气
B. 收集氧气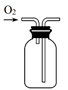
C. 分离出MnO2
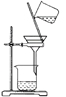 D. 蒸发结晶得KCl
D. 蒸发结晶得KCl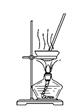
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. pH=1的溶液:Na+、K+、MnO4-、SO42-
B. 0.1mol·L-1FeCl3溶液:K+、NH4+、I-、SCN-
C. 使酚酞变红色的溶液:Na+、Al3+、CO32-、Cl-
D. 由水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Na+、AlO2-、CO32-
难度: 困难查看答案及解析
-
利用合成气(主要成分为CO、CO2和H2)通过下列反应合成甲醇。下列说法正确的是
反应①:CO2(g) + H2(g)
CO(g) + H2O(g) △H1=41 kJ·mol–1
反应②:CO(g) + 2H2(g)
CH3OH(g) △H2=–99 kJ·mol–1
反应③:CO2(g) + 3H2(g)
CH3OH(g) + H2O(g) △H3
A. 反应①为放热反应 B. 增大反应①的压强,H2转化率提高
C. 反应②使用催化剂,△H2不变 D. △H3=-58 kJ·mol–1
难度: 困难查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是
A.
B.
C.
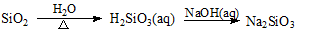
D.
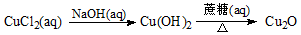
难度: 中等查看答案及解析
-
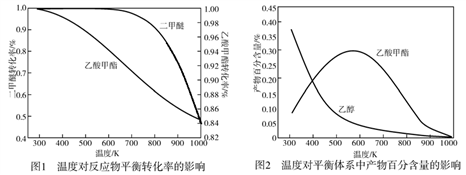
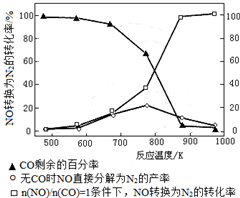
下列图示与对应的叙述相符合的是
A. 图1表示平衡2NO2(g)
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
B. 图2表示除去CuSO4溶液中的Fe3+可采用加入CuO调节溶液pH到4~5
C. 图3表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,则碱性:MOH>ROH
D. 图4为KNO3和NaCl溶解度曲线,若除去NaCl中少量的KNO3,可在较高温度下制得浓溶液后,再冷却结晶、过滤、洗涤、干燥得纯净NaCl
难度: 困难查看答案及解析
-
伞形酮可由雷琐苯乙酮和苹果酸在一定条件下反应制得,下列说法正确的是
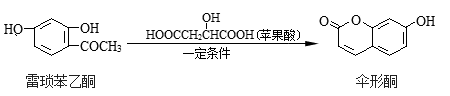
A. 雷琐苯乙酮中含有1个手性碳原子
B. 雷琐苯乙酮不能与碳酸钠溶液反应
C. 伞形酮和雷琐苯乙酮都能与FeCl3溶液发生显色反应
D. 1 mol伞形酮与NaOH溶液反应,最多可消耗2 mol NaOH
难度: 中等查看答案及解析
-
一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,下列说法正确的是
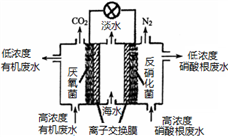
A. 该电池能在高温下工作
B. 该电池工作时,中间室中的Cl-移向右室
C. 正极上发生的电极反应:2NO3-+ 6H2O + 10e-═ N2 ↑+ 12OH-
D. 若有机废水中有机物用C6H12O6表示,每消耗1 mol C6H12O6 转移4 mol电子
难度: 困难查看答案及解析
-
根据下列实验操作和现象所得结论正确的是
实验操作和现象
实验结论
A
分别向2 mL 0.1 mol·L–1 CH3COOH溶液和2 mL 0.1 mol·L–1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象
酸性:CH3COOH>H2CO3>H3BO3
B
用3 mL稀盐酸与过量Zn反应,当气泡稀少时,加入1 mL 浓盐酸,又迅速产生较多气泡
盐酸浓度增大,反应速率加快
C
向少量无水乙醇中加入一小粒金属Na,生成可燃性气体
CH3CH2OH是弱电解质
D
向2 mL 0.1 mol·L–1 NaOH溶液中滴加3滴0.1 mol·L–1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1 mol·L–1 FeCl3溶液,出现红褐色沉淀
Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
20℃时,向20 mL 0.1 mol·L-1的Na2CO3溶液中逐滴加入0.1 mol·L-1盐酸(忽略H2CO3的分解和CO2的挥发),溶液pH随盐酸加入的体积变化曲线如图。下列说法正确的是
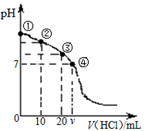
A. 点①所示溶液中:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B. 点②所示溶液中:c(CO32-)>c(Cl-)>c(HCO3-)>c(OH-)
C. 点③所示溶液中:c(OH-)﹣c(H+)=c(H2CO3)﹣c(CO32-)
D. 点④所示溶液中:c(Cl-)=2c(H2CO3) + c(HCO3-)
难度: 困难查看答案及解析
-
在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g) + B(g)
2D(g) △H=Q kJ·mol–1。相关条件和数据见下表:
实验编号
实验Ⅰ
实验Ⅱ
实验Ⅲ
反应温度/℃
700
700
750
达平衡时间/min
40
5
30
n(D)平衡/ mol
1.5
1.5
1
化学平衡常数
K1
K 2
K 3
下列说法正确的是
A. K 3>K 2=K 1
B. 实验Ⅱ可能使用了催化剂
C. 实验Ⅲ达平衡后容器内的压强是实验Ⅰ的
倍
D. 实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡不移动
难度: 困难查看答案及解析
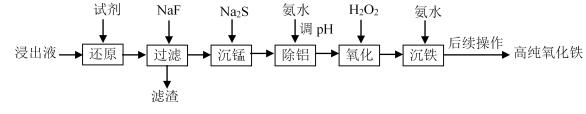
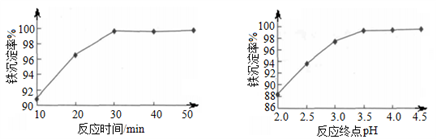
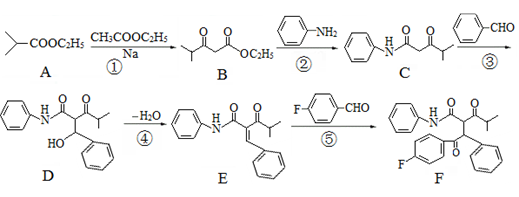
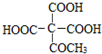 ,写出相应的合成路线流程图________(无机试剂任用,合成路线流程图示例见本题题干)。
,写出相应的合成路线流程图________(无机试剂任用,合成路线流程图示例见本题题干)。