-
实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:
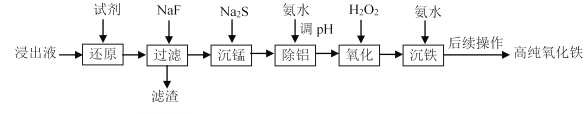
已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
| 氢氧化物 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 |
| 沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L−1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
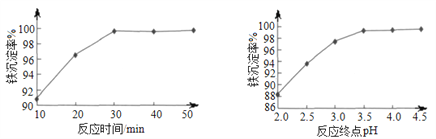
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。
-
实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:
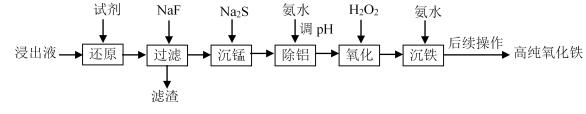
已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
| 氢氧化物 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 |
| 沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L−1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
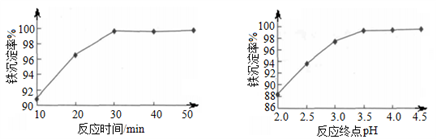
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。
-
金属钇(Y)具有重要的国防价值,但因过度开采已濒临枯竭。通过硫酸浸泡深海磷灰石矿,可以得到Y3+的浸出液:
表1 浸出液成分
| Al3+ | Fe3+ | Ca2+ | PO43- | Mg2+ | Mn2+ | Y3+ |
| 浓度/(mg•L-1) | 7670 | 9460 | 550 | 640 | 5600 | 1500 | 70.2 |
(1)浸出液可用有机溶剂(HR)进行萃取,实现Y3+的富集(已知:Y3+与Fe3+性质相似),原理如下:Fe3+ + 3HR  FeR3 + 3H+ Y3+ + 3HR
FeR3 + 3H+ Y3+ + 3HR  YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)
YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)
浸出液在不同pH下萃取的结果如图1。
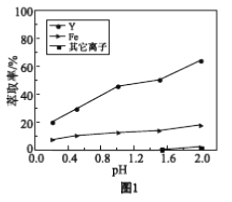
①用化学平衡原理解释,随pH增大,Y3+萃取率增大的原因________。
②结合图1解释,工业上萃取Y3+之前,应首先除去Fe3+的原因是________。
(2)采用“中和沉淀法”和“磷酸法”可以除铁。
表2 Fe3+、Y3+去除率
| 终点pH | 去除率/% |
| Fe3+ | Y3+ |
| 3.0 | 87.84 | 19.86 |
| 3.5 | 92.33 | 23.63 |
| 4.5 | 99.99 | 44.52 |
| 5.0 | 99.99 | 89.04 |
中和沉淀法:向浸出液中加入NaOH除Fe3+,去除率如表2所示。
①该实验条件下,Fe3+去除率比Y3+大的可能原因________。
磷酸法:将磷酸(H3PO4:三元弱酸)加入到浸出液中,再加入Na2CO3溶液,调pH为2.5,过滤除去磷酸铁沉淀(FePO4),滤液中剩余的Fe3+、Y3+浓度如表3。
表3 滤液中Fe3+、Y3+的浓度
| Fe3+ | Y3+ |
| 浓度/(mg•L-1) | 508 | 68.9 |
② 配平“磷酸法”除铁过程中的离子方程式
Fe3+ + + = FePO4↓+ CO2↑+ ,___________________
③ 综合分析表1、表2、表3,工业上采用“磷酸法”除铁的原因________。
(3)经“磷酸法”除铁后,用有机溶剂HR萃取Y3+,可通过________(填操作)收集含Y3+的有机溶液。
(4)综合分析以上材料,下列说法合理的是________。
a. 分析图1可知,pH在0.2~2.0范围内,有机溶剂中的Fe3+多于水溶液中的Fe3+
b. 表2中 Y3+损失率在20%左右的原因可能是生成的Fe(OH)3对Y3+的吸附
c. 表2中 pH在4.5~5.0范围内,Y3+损失率变大的可能原因:Y3+ + 3OH- = Y(OH)3↓
d. 有机溶剂萃取Y3+的优点是Ca2+、Mg2+、Mn2+等金属离子萃取率极低
-
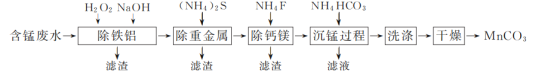
以硫酸法钛白粉生产中排放的含锰废水(主要金属离子为Mn2+、Fe2+、Al3+,还含有少量Ca2+、Mg2+、Cu2+和Ni2+等离子)为原料,生产MnCO3的工艺流程如下:
已知:25 ℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
(1)流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为__________________________________________。
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中 =________。
=________。
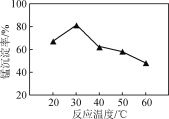
(2) 沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。
①沉锰过程发生反应的离子方程式为____________。该过程中加入适当过量的NH4HCO3的原因是________。
②当温度超过30 ℃,沉锰反应的锰沉淀率随温度升高而下降的原因是______________________________。
(3) 沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是____________________________。
-
工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
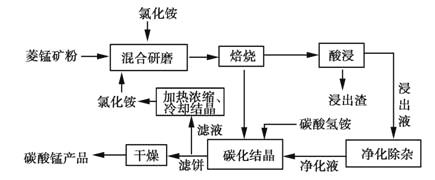
已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
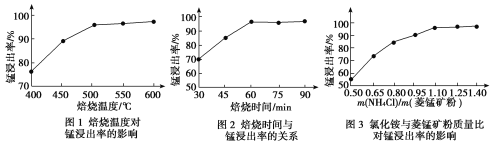
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、 分别为_____、_____、_______。
分别为_____、_____、_______。
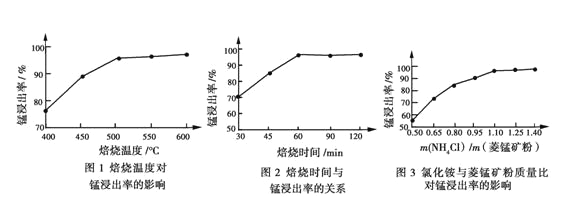
(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_______,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为______________。
(4)上述流程中可循环使用的物质是________。
(5)现用滴定法测定浸出液中Mn2+的含量。实验步骤:称取1.000 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应2Mn2++ +4
+4 +2H+
+2H+ 2[Mn(PO4)2]3−+
2[Mn(PO4)2]3−+ +H2O充分进行;加入稍过量的硫酸铵,发生反应
+H2O充分进行;加入稍过量的硫酸铵,发生反应 +
+
 N2↑+2H2O以除去
N2↑+2H2O以除去 ;加入稀硫酸酸化,用2.00 mol·L−1 10.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3−+Fe2+
;加入稀硫酸酸化,用2.00 mol·L−1 10.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3−+Fe2+ Mn2++ Fe3++2
Mn2++ Fe3++2 ;用0.10 mol·L−110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用0.10 mol·L−110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________(还原产物是Cr3+)。
②试样中锰的质量分数为_______。
-
工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
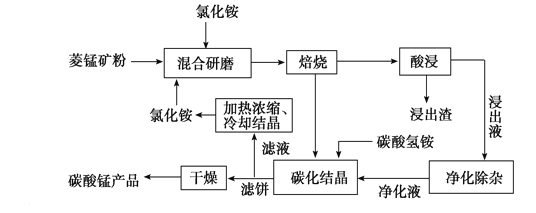
已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl  MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(菱锰矿粉)分别为____________、____________、____________。
(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围__,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为____。
(4)上述流程中可循环使用的物质是________。
(5)现用滴定法测定浸出液中Mn2+的含量。实验步骤:称取1.000 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应2Mn2++NO3-+4PO43-+2H+ 2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应(还原产物是Cr3+)的离子方程式为___________。
②试样中锰的质量分数为________。
-
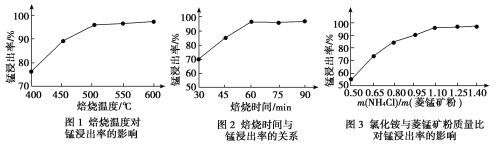
工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:
已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl  MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(菱锰矿粉)分别为____________、____________、____________。
(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围__,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为____。
(4)上述流程中可循环使用的物质是________。
(5)现用滴定法测定浸出液中Mn2+的含量。实验步骤:称取1.000 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应2Mn2++NO3-+4PO43-+2H+ 2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应(还原产物是Cr3+)的离子方程式为___________。
②试样中锰的质量分数为________。
-
利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图:
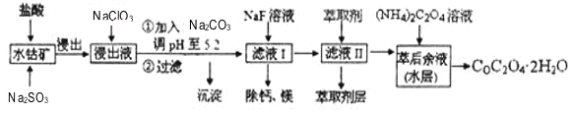
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
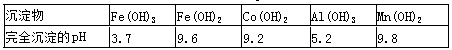
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是_____。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为_____。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_____。
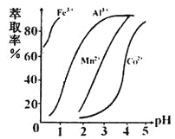
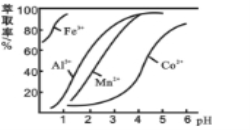
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,在滤液II中适宜萃取的pH为_____左右。
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液 =____。
=____。
(6)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K=1.8×10-5,H2SO3的电离平衡常数K1=1.2×10-2,K2=1.3×10-8。在通废气的过程中,当恰好形成正盐时,溶液中离子浓度的大小关系为____。
-
利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下:

已知①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是_____________。
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为__________________ ;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为_______________ (标准状况)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。
滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______(填选项序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。
已知K sp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c(Ca2+)=________________。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K1 =1.8×10-5mol·L-1H2SO4的电离平衡常数K2=1.2×10-2mol·L-1,K3 =1.3×10-8mol·L-1。在通入废气的过程中:
当恰好形成正盐时,溶液中离子浓度的大小关系为____________________________。
-
利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是_____________。
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为 ;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为 (标准状况)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______(填选项序号)。
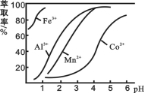
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c(Ca2+)=________________。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K1 =1.8×10-5mol·L-1H2SO4的电离平衡常数K2=1.2×10-2mol·L-1,K3 =1.3×10-8mol·L-1。在通入废气的过程中:
①当恰好形成正盐时,溶液中离子浓度的大小关系为 。
②当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为 。



















