金属的回收和冶炼能有效利用金属资源
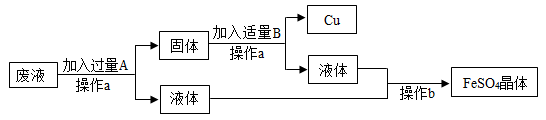
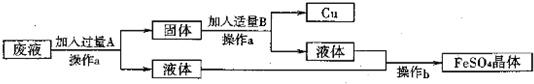
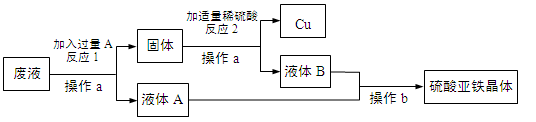
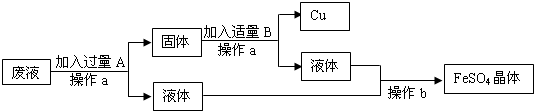
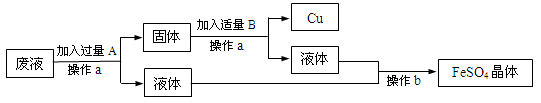
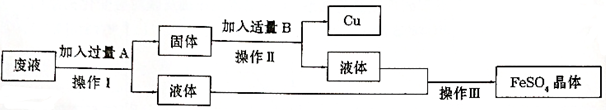
(1)某工厂欲从只含有硫酸铜的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
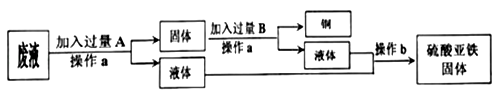
回答下列问题:
①A、B物质的名称:A为____,B为___;②A与废液主要成分反应的化学方程式为____
(2)某钢铁厂每天需消耗4900t含氧化铁76%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量__。
【答案】 铁 稀硫酸 Fe+CuSO4═FeSO4+Cu 2660t
【解析】(1)①欲从只含有硫酸铜的废液中回收金属铜,并得到硫酸亚铁,故A是铁,Fe+CuSO4═FeSO4+Cu。因为要得到硫酸亚铁,故B是稀硫酸,Fe+ H2SO4 == FeSO4 + H2↑。②废液的主要成分是硫酸铜,铁与硫酸铜反应的化学方程式为:Fe+CuSO4═FeSO4+Cu。
(2)4900t赤铁矿石中氧化铁的质量为:4900t×76%=3724t,设理论上可日产含铁98%的生铁的质量是x,则生铁中铁的质量为x×98%。
Fe2O3+3CO 高温2Fe+3CO2
160 112
3724t x×98%
=
,解得x=2660t
点睛:对于该类流程题,首先认真审题,明确要回收什么物质,然后考虑如何用化学试剂从废液中回收。
【题型】流程题
【结束】
25
钙是维持人体正常功能所必需的元素,葡萄糖酸钙(C12H22O14Ca)是常用的补钙剂,回答下列问题
(1)葡萄糖酸钙的相对分子质量;
(2)葡萄糖酸钙中碳与氧元素的质量比;
(3)葡萄糖酸钙中钙元素的质量分数(精确到0.1%)。
九年级化学计算题中等难度题