-
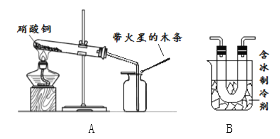
硝酸铜为蓝色固体,溶于水可得蓝色溶液。某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。
(提出问题)硝酸铜在加热条件下到底发生了怎样的反应?
(查阅资料)
(1)氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4  CuSO4+H2O
CuSO4+H2O
(2)含氮化合物中,只有NO2是红棕色、有刺激性气味的气体。
(3)NO2有助燃性,能使带火星的木条复燃
(猜想假设)
Cu(NO3)2受热分解除了生成_____________,还可能生成了CuO和O2。
(进行实验)
| 实验操作 | 实验现象 | 实验结论 |
| (1)将反应后试管中的固体加水充分溶解,过滤,洗涤,向滤渣中加入____________,加热 | 固体全部溶解,得到_____色溶液 | 硝酸铜分解生成了氧化铜。 |
| (2)在图A的试管和集气瓶之间连上图B所示的装置,重新进行加热硝酸铜的实验 | 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解________(“有”或“无”)氧气生成。 |
步骤(2)是同学们查阅了新的资料后才设计完成的。该资料体现的是有关二氧化氮______的物理性质信息。
(获得结论)根据实验结果,Cu(NO3)2受热分解的化学方程式为________________。
(反思与评价)
已知相同状况下,气体的体积比等于其分子个数比。据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性。理由是_____________________。
-
(6分)硝酸铜为蓝色固体,溶于水可得蓝色溶液。某实验小组同学用下图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。
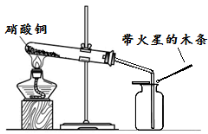
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4 CuSO4+H2O
CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体。
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成_______,还可能生成了CuO和O2。
【进行实验】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤I:将反应后试管中的固体加水充分溶解, ① ,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜。 |
| 步骤II:在图1的试管和集气瓶之间连上如图所示的装置,重新进行加热硝酸铜的实验 
| 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解生成了氧气 |
步骤II是同学们查阅了新的资料后设计完成的。该资料是关于NO2___②__方面的性质信息。
【获得结论】根据实验结果,Cu(NO3)2受热分解的化学方程式为_______。
【反思与评价】已知相同状况下,气体的体积比等于其分子个数比。据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性。理由是______。
-
加热硝酸铜[Cu(NO3)2]可以制取氧化铜。用图1装置加热蓝色硝酸铜固体。发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃。
[提出问题]硝酸铜加热生成什么气体?
[查阅资料]①含氮化合物中,只有二氧化氮是红棕色、有刺激性气味的气体
②二氧化氮密度大于空气,具有助燃性,…………
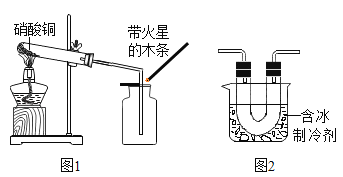
[猜想假设]猜想一:生成气体是(填写化学式)________________。
猜想二:生成气体是二氧化氮和氧气
[进行实验]在图1的试管和集气瓶之间连接图2所示装置,重新加热硝酸铜;
[实验现象]________________。
[实验结论]猜想二正确:写出有关化学反应文字表达式:________________。
[反思与评价](1)根据图2装置补充参阅资料②中“………..”NO2的性质是________________。
(2)化学反应前后原子个数不变,经计算生成二氧化氮与氧气的分子个数比为4:1;已知相同状况下,气体的体积比等于其分子个数比。据此,同学们认为,即使没有资料②,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出二氧化氮可能具有助燃性。理由是________________。
[实验延伸]取制取的氧化铜0.2g,加入5mL5%的双氧水中,发现立即产生大量气泡,带火星木条复燃;氧化铜是否为反应催化剂?请补充实验证明。
| 实验操作 | 实验现象 | 实验结论 |
| _______________ | __________________ | 氧化铜在反应前后质量化学性质不变,是双氧水制取氧气的催化剂。 |
| ________________ | _________________ |
-
实验小组的同学发现:加热铜与浓硫酸的混合物,能生成一种无色有刺激性气味的气体和蓝色溶液.
(1)①某些不活泼的金属(如铜)能与一些强氧化性的酸(如浓硫酸)发生反应,生成水而不生成氢气,同时生成二氧化硫和铜盐.
②硫酸铜溶于水后,溶液呈酸性.铜、银(能、不能)与稀硫酸、盐酸反应产生氢气.
(2)①对于生成的蓝色溶液,小东认为可能是Cu(NO3)2溶液,小楠认为不可能是Cu(NO3)2溶液,而可能是硫酸铜溶液,小楠的理由是.
②写出铜与浓硫酸共热的化学方程式.
③小东根据化学方程式说,该方法适用于以铜为原料大量制取硫酸铜,小田认为不适宜,你能说出小田的一个理由吗?.
(3)【提出问题】上述蓝色溶液中有无硫酸剩余?
(4)【实验论证】小坤认为可向蓝色溶液中滴加氯化钡溶液,观察有无沉淀产生,经大家讨论后,该方案被否定,你觉得否定该方案的理由是.
(5)【反思评价】
①有同学提问:为什么不可以用石蕊试液来进行检验?你的回答是
.
②同学们发现:将足量的铜和足量的浓硫酸置容器中加热,反应一段时间后,反应会逐渐变慢,最后反应停止,你能说出反应停止的原因吗.
-
某兴趣小组同学利用如图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应开始后试管中出现红色固体同时产生无色无味气体。兴趣小组同学进行了以下探究。

实验1:向5份相同体积的硫酸铜溶液中分别加入表面经过打磨处理的相同长度的铝条,现象如下:
| 实验组别 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 硫酸铜溶液浓度 | 24% | 12% | 8% | 6% | 5% | 3% | 1% |
| 气泡情况 | 很快 | 快 | 较快 | 快 | 较快 | 慢 | 无 |
实验2:向质量分数为8%的硫酸铜溶液分别加入表面经过打磨处理的相同长度的铝条,现象如图所示:
| 实验组别 | ① | ② | ③ | ④ | ⑤ |
| 水浴温度(℃) | 20 | 30 | 40 | 50 | 60 |
| 气泡情况 | 较快 | 快 | 很快 | 很快 | 很快 |
(1)实验1的目的是______。
(2)实验2的结论是______。
(3)依据实验1和实验2,推测50℃5% 硫酸铜溶液与铝条反应的现象是______。
(反思与评价)
(4)实验2没有进行温度为70℃的实验,理由是______。
(5)根据你的猜想,气泡中的气体是______。
-
某兴趣小组同学利用如图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应开始后试管中出现红色固体同时产生无色无味气体。兴趣小组同学进行了以下探究。

实验1:向5份相同体积的硫酸铜溶液中分别加入表面经过打磨处理的相同长度的铝条,现象如下:
| 实验组别 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 硫酸铜溶液浓度 | 24% | 12% | 8% | 6% | 5% | 3% | 1% |
| 气泡情况 | 很快 | 快 | 较快 | 快 | 较快 | 慢 | 无 |
实验2:向质量分数为8%的硫酸铜溶液分别加入表面经过打磨处理的相同长度的铝条,现象如图所示:
| 实验组别 | ① | ② | ③ | ④ | ⑤ |
| 水浴温度(℃) | 20 | 30 | 40 | 50 | 60 |
| 气泡情况 | 较快 | 快 | 很快 | 很快 | 很快 |
(1)实验1的目的是______。
(2)实验2的结论是______。
(3)依据实验1和实验2,推测50℃5% 硫酸铜溶液与铝条反应的现象是______。
(反思与评价)
(4)实验2没有进行温度为70℃的实验,理由是______。
(5)根据你的猜想,气泡中的气体是______。
-
某兴趣小组在蒸发浓缩FeCl3溶液时发现有刺激性气味的气体生成,同时溶液中出现红褐色固体。小组同学对刺激性气味气体做出猜想:
(猜想)①Cl2 ②HCl ③_____。
(资料)①Cl2溶于水,形成的溶液显酸性,具有较强的漂白能力,能使石蕊溶液褪色。
②红褐色固体碱式氯化铁晶体的化学式为Fe2(OH)aClb•xH2O,它在50℃时开始失去部分结晶水,在200℃完全分解为Fe2O3、H2O、HCl气体。
③浓H2SO4不吸收HCl气体。
(1)小组同学将生成的气体通入紫色石蕊溶液中看到_____现象,证明猜想②成立。
(2)为确定固体的组成,进行如下实验:
(实验)称取50.4g固体按下图进行实验。充分持续加热至200℃,最终得到Fe2O316.0g,B、C装置最终分别增重19.8g、14.6g。

①加热前、后均需通入氮气,停止加热后通氮气的目的是防止倒吸和_____。
②晶体的化学式中a∶b=_____,若缺失D装置,实验测得的b值会_____(选填“偏大”、“偏小”或“不变”)。x=_____。
③请写出该红褐色固体在200℃时发生反应的总化学方程式_____。
-
下列实验现象描述正确的是
A.铜片放入硝酸银溶液中:紫红色固体表面有银白色固体析出,溶液由无色逐渐变为蓝色
B.打开浓盐酸试剂瓶,在瓶口有白烟产生
C.铁丝在空气中加热:银白色固体剧烈燃烧,火星四射,放出大量的热,生成黑色固体
D.铜片放入稀盐酸中:紫红色固体表面产生气泡,固体减少,溶液由无色逐渐变为蓝色,放热
-
某兴趣小组同学利用下图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应开始后试管中出现红色固体同时产生无色无味气体。兴趣小组同学进行了以下探究。

实验1:向5份相同体积的硫酸铜溶液中分别加入表面经过打磨处理的相同长度的铝条,现象如下:
| 实验组别 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 硫酸铜溶液浓度 | 24% | 12% | 8% | 6% | 5% | 3% | 1% |
| 气泡情况 | 很快 | 快 | 较快 | 快 | 较快 | 慢 | 无 |
实验2:向质量分数为8%的硫酸铜溶液分别加入表面经过打磨处理的相同长度的铝条,现象如下:
| 实验组别 | ① | ② | ③ | ④ | ⑤ |
| 水浴温度(℃) | 20 | 30 | 40 | 50 | 60 |
| 气泡情况 | 较快 | 快 | 很快 | 很快 | 很快 |
(1)实验1的目的是______。
(2)实验2的结论是______。
(3)依据实验1和实验2,推测50℃ 5% 硫酸铜溶液与铝条反应的现象是________。
(反思与评价)
(4)实验2没有进行温度为70℃的实验,理由是_______。
(5)根据你的猜想,气泡中的气体是______。
-
某兴趣小组同学利用下图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应开始后试管中出现红色固体的同时产生无色无味气体,兴趣小组同学进行了以下探究:
实验1:向7支盛有相同体积、相同温度硫酸铜溶液的试管中,分别加入表面经过打磨处理的相同长度的铝条,现象如下:
| 实验组别 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 硫酸铜溶液浓度 | 24% | 12% | 8% | 6% | 5% | 3% | 1% |
| 气泡情况 | 很快 | 快 | 较快 | 快 | 较快 | 慢 | 无 |
实验2:向5支盛有相同体积、质量分数为8%硫酸铜溶液的试管中,分别加入表面经过打磨处理的相同长度的铝条,然后放在不同温度的水浴中(如图所示),现象如下:
| 实验组别 | ① | ② | ③ | ④ | ⑤ |
| 水浴温度(℃) | 20 | 30 | 40 | 50 | 60 |
| 产生气泡情况 | 较快 | 快 | 很快 | 很快 | 很快 |

(1)实验1的目的是______。
(2)实验2的结论是_____。
(3)依据实验1和实验2.推测50℃时5%硫酸铜溶液与铝条反应的现象是____。
(反思与评价)
(4)实验2没有进行温度为70℃的实验,理由是_____。
(5)根据你的猜想,气泡中的气体可能是_____。

CuSO4+H2O







