-
高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
| 序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
| A | 98% | 室温 | 无 | 72s |
| B | 65% | 室温 | 无 | 129s |
| C | 65% | 50℃ | 无 | 16s |
| D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。
-
高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
| 序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
| A | 98% | 室温 | 无 | 72s |
| B | 65% | 室温 | 无 | 129s |
| C | 65% | 50℃ | 无 | 16s |
| D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。
-
高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
| 序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
| A | 98% | 室温 | 无 | 72s |
| B | 65% | 室温 | 无 | 129s |
| C | 65% | 50℃ | 无 | 16s |
| D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。
-
高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
| 序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
| A | 98% | 室温 | 无 | 72s |
| B | 65% | 室温 | 无 | 129s |
| C | 65% | 50℃ | 无 | 16s |
| D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。
-
高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾的腐蚀性进行研究。
(查阅资料)KMnO4溶液呈中性,有腐蚀性。
(进行实验)
实验1:将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如下表。
| KMnO4溶液浓度 | 0.002% | 0.01% | 0.1% | 1% |
| 鸡皮的变化 | 无明显变化 | 边缘部分变为棕黄色 | 全部变为棕色 | 全部变为黑色 |
实验2:将几种物质在0.1%的高锰酸钾溶液中浸泡相同时间,现象如下表。
| 物质 | 铁 | 铜 | 硫 | 活性炭 |
| 现象 | 无明显现象 | 无明显现象 | 有少量刺激性气味气体冒出 | 有无色气体冒出 |
实验3:将铜片分别浸泡在4种溶液中进行实验,所得数据如下表。
| 编号 | ① | ② | ③ | ④ |
| 实验 | 
25mL0.1%KMnO4溶液 | 
25mL0.1%KMnO4溶液+10滴浓硫酸 | 
25mL蒸馏水+10滴浓硫酸 | 
25mL1%KMnO4溶液+10滴浓硫 |
| 铜片质量/g | 实验前 | 0.54 | 0.54 | a | 0.54 |
| 18小时后 | 0.54 | 0.52 | 0.54 | 0.43 |
(解释与结论)
(1)实验1的目的是_____。
(2)下列有关实验2的说法正确的是_____(填序号)。
A 在该实验条件下高锰酸钾溶液对硫的腐蚀比对铜的腐蚀更明显
B 硫被高锰酸钾腐蚀生成的刺激性气味气体可能是SO2
C 铁和铜与高锰酸钾溶液一定不反应
(3)实验2中,活性炭被高锰酸钾腐蚀,产生的气体能使澄清石灰水变浑浊,补全活性炭与高锰酸钾反应的化学方程式。
C+2KMnO4===K2MnO4+MnO2+_____↑
(4)实验3中③,a为_____。
(5)实验3中,通过对比②和④,得出的结论是_____。
(6)实验3中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比_____(填编号)。
-
纳米材料常常具有一些特殊性质,纳米铁粉在隐形材料喷涂方面有着球形铁粉无可比拟的优越性,广泛用于国防军工领域,某化学小组通过动手实验制备纳米铁粉。
(查阅资料)
(1)用硫酸亚铁、草酸(H2C2O4)两溶液发生复分解反应来制备草酸亚铁(FeC2O4)。
常温下,草酸亚铁的溶解度较小。
(2)焙烧草酸亚铁: FeC2O4  Fe+2CO2↑。
Fe+2CO2↑。
(3)纳米铁粉在空气容易被氧化生成氧化铁。
(实验步骤)

(1)草酸亚铁晶体的制备如图1
①若配制的硫酸亚铁溶液略呈黄色,可能原因是___________________;
②写出硫酸亚铁与草酸溶液反应的化学方程式_________________;
③为了分离所得固体沉淀物,需要的玻璃仪器有烧杯、玻璃棒_______;
④用冰水洗涤固体沉淀物到 pH =7为止的目的是_________________;
(2)纳米铁粉的制备如图2
将一根玻璃管在酒精喷灯上烧制成如图2所示形状,向其中加入黄色草酸亚铁晶体.当草酸亚铁粉末受热完全变黑,立即将管口部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
①分解草酸亚铁的实验中所产生的CO2对于该实验步骤所起的作用是________。
②指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间.你认为烧熔过早、过晚的后果分别是______________________,___________。
-
纳米材料常常具有一些特殊性质,纳米铁粉在隐形材料喷涂方面有着球形铁粉无可比拟的优越性,广泛用于国防军工领域,某化学小组通过动手实验制备纳米铁粉。
(查阅资料)
(1)用硫酸亚铁、草酸(H2C2O4)两溶液发生复分解反应来制备草酸亚铁(FeC2O4)。
常温下,草酸亚铁的溶解度较小。
(2)焙烧草酸亚铁: FeC2O4  Fe+2CO2↑。
Fe+2CO2↑。
(3)纳米铁粉在空气容易被氧化生成氧化铁。
(实验步骤)

(1)草酸亚铁晶体的制备如图1
①若配制的硫酸亚铁溶液略呈黄色,可能原因是___________________;
②写出硫酸亚铁与草酸溶液反应的化学方程式_________________;
③为了分离所得固体沉淀物,需要的玻璃仪器有烧杯、玻璃棒_______;
④用冰水洗涤固体沉淀物到 pH =7为止的目的是_________________;
(2)纳米铁粉的制备如图2
将一根玻璃管在酒精喷灯上烧制成如图2所示形状,向其中加入黄色草酸亚铁晶体.当草酸亚铁粉末受热完全变黑,立即将管口部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
①分解草酸亚铁的实验中所产生的CO2对于该实验步骤所起的作用是________。
②指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间.你认为烧熔过早、过晚的后果分别是______________________,___________。
-
某化学兴趣小组通过查阅资料得知:固体草酸(H2C2O4•2H2O)受热可分解,其化学方程式为:H2C2O4•2H2O
 CO↑+CO2↑+3H2O,该课题小组的同学在实验室分别进行了如下实验,回答下列问题:
CO↑+CO2↑+3H2O,该课题小组的同学在实验室分别进行了如下实验,回答下列问题:
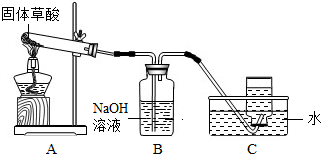
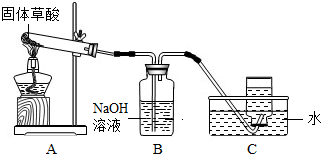
(1)甲同学利用如图装置制取并收集CO.
①试管口略向下倾斜的原因是;
②B装置的作用.
(2)乙同学为了验证草酸的分解产物,设计了四个方案,分别将混合气体(包括水蒸气)依次通过足量的下列试剂:
A.石灰水、灼热的氧化铜、无水硫酸铜、氢氧化钠溶液
B.无水硫酸铜、氢氧化钠溶液、灼热的氧化铜、石灰水
C.石灰水、无水硫酸铜、灼热的氧化铜、石灰水
D.无水硫酸铜、石灰水、灼热的氧化铜、石灰水
其中正确的方案是.
(3)丙同学按下列装置利用草酸分解产生的CO测定某种铁的氧化物的组成.
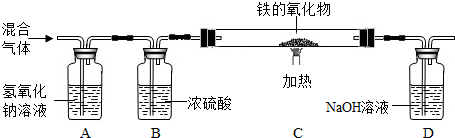
①丁同学认为去掉A装置,对测定结果无影响,他的观点(填“正确”或“不正确”),判断理由是.而戊同学认为从环保的角度考虑应在D装置后再增加装置,若无此装置,对测定结果是否有影响?(填“是”或“否”).
②当C装置中铁的氧化物全部被还原后,称量剩余的质量为11.2g,同时测得D装置的质量增加13.2g,则该铁的氧化物中铁元素和氧元素的质量比为.
-
某化学兴趣小组通过查阅资料得知:固体草酸受热可分解其化学方程式为H2C2O4•2H2O≜CO↑+CO2↑+3H2O,
该课题小组的同学在实验室分别进行了如下实验
请回答下列问题:
(1)甲同学利用右图装置制取并收集CO:
①B装置的作用______.
②CO集满后,将集气瓶由水槽中加盖取出,然后先______,再______.
(2)乙同学为了验证草酸的分解产物,设计了四个方案,分别将混合气体(包括水蒸气)依次通过足量的下列试剂:
A.石灰水、灼热的氧化铜、无水硫酸铜、氢氧化钠溶液
B.无水硫酸铜、氢氧化钠溶液、灼热的氧化铜、石灰水
C.石灰水、无水硫酸铜、灼热的氧化铜、石灰水
D.无水硫酸铜、石灰水、灼热的氧化铜、石灰水
你认为其中正确的方案是______.
(3)丙同学按下图装置利用草酸分解产生的CO测定某种铁的氧化物的组成.
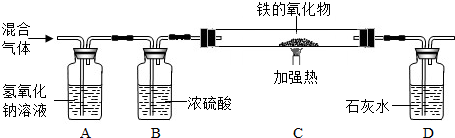
①当C装置中铁的氧化物全部被还原后,称量剩余的质量为a g,同时测的D装置的质量增加b g,则该铁的氧化物中铁元素和氧元素的质量比为______.
②丁同学认为去掉A装置,对测定结果无影响,他的观点______(填“正确”或“不正确”)你的判断理由是______.而戊同学认为在D装置后还应再增加某装置,该装置是______;若无此装置,对测定结果是否有影响?______(填“是”或“否”)
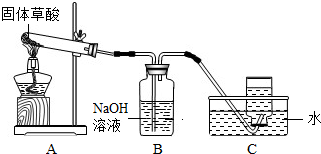
-
某化学兴趣小组通过查阅资料得知:固体草酸受热可分解其化学方程式为H2C2O4•2H2O≜CO↑+CO2↑+3H2O,
该课题小组的同学在实验室分别进行了如下实验
请回答下列问题:
(1)甲同学利用右图装置制取并收集CO:
①B装置的作用______.
②CO集满后,将集气瓶由水槽中加盖取出,然后先______,再______.
(2)乙同学为了验证草酸的分解产物,设计了四个方案,分别将混合气体(包括水蒸气)依次通过足量的下列试剂:
A.石灰水、灼热的氧化铜、无水硫酸铜、氢氧化钠溶液
B.无水硫酸铜、氢氧化钠溶液、灼热的氧化铜、石灰水
C.石灰水、无水硫酸铜、灼热的氧化铜、石灰水
D.无水硫酸铜、石灰水、灼热的氧化铜、石灰水
你认为其中正确的方案是______.
(3)丙同学按下图装置利用草酸分解产生的CO测定某种铁的氧化物的组成.
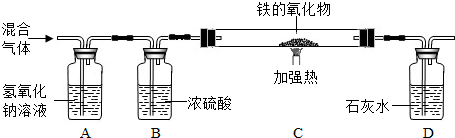
①当C装置中铁的氧化物全部被还原后,称量剩余的质量为a g,同时测的D装置的质量增加b g,则该铁的氧化物中铁元素和氧元素的质量比为______.
②丁同学认为去掉A装置,对测定结果无影响,他的观点______(填“正确”或“不正确”)你的判断理由是______.而戊同学认为在D装置后还应再增加某装置,该装置是______;若无此装置,对测定结果是否有影响?______(填“是”或“否”)