-
实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)初步探究:Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含________________;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
| 操作 | 现象 | 结论 |
| 向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有______ |
| 取上层清液,滴加_____ | ________ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是_____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:

同学们认为原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是________(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)深入探究:在老师的指导下同学们取原固体,进行如下实验:
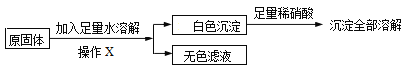
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是_____,则原固体中一定不含_______;其中,操作X的名称是______,无色滤液中一定含有的阳离子是____________。
-
实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
[定性探究]
(1)称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含_____。
(2)取(1)中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
| 操作 | 现象 | 结论 |
| ①向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有_____ |
| ②取①中上层清液,滴加_____ | _____ | 原固体中不含NaOH |
其中,步骤①加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是_____。
(3)再取(1)中得到的滤液少量,进行如图1所示操作:
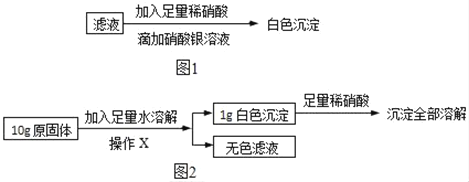
同学们认为:原固体中一定含有NaCl.但是老师指出这个结论不正确,其理由是_____(填序号)。
A 滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B 滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
[定量探究]
(4)在老师的指导下同学们又精确称量了10g原固体,进行如图2实验:
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是_____,则原固体中一定不含_____;其中,操作X的名称是_____,无色滤液中一定含有的阳离子是_____。根据生成沉淀的质量计算原固体中氯化钙的质量分数是_____。
-
实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
[定性探究]
(1)称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含_____。
(2)取(1)中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
| 操作 | 现象 | 结论 |
| ①向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有_____ |
| ②取①中上层清液,滴加_____ | _____ | 原固体中不含NaOH |
其中,步骤①加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是_____。
(3)再取(1)中得到的滤液少量,进行如图1所示操作:
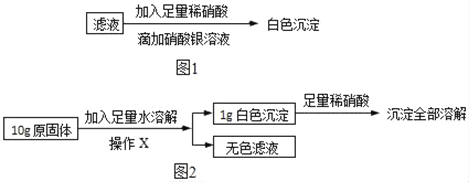
同学们认为:原固体中一定含有NaCl.但是老师指出这个结论不正确,其理由是_____(填序号)。
A 滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B 滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
[定量探究]
(4)在老师的指导下同学们又精确称量了10g原固体,进行如图2实验:
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是_____,则原固体中一定不含_____;其中,操作X的名称是_____,无色滤液中一定含有的阳离子是_____。根据生成沉淀的质量计算原固体中氯化钙的质量分数是_____。
-
实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)定性探究:
Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含____;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
| 操作 | 现象 | 结论 |
| 向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有____ |
| 取上层清液,滴加____ | ____ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:

同学们认为:原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是___(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)定量探究:
在老师的指导下同学们又精确称量了10g原固体,进行如下实验:
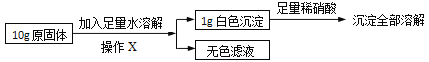
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是____,则原固体中一定不含____;其中,操作X的名称是____,无色滤液中一定含有的阳离子是____。
试根据生成沉淀的质量计算原固体中氯化钙的质量分数,写出计算过程_____。
-
有一种不纯的Na2CO3固体粉末,可能含有K2SO4、BaSO4、CuSO4、NaCl、CaCl2中的一种或几种.为确定含有的杂质,现进行下列实验:
(1)取该样品溶于水,得无色溶液,则该固体粉末中一定不含有______.
(2)取上述溶液适量,滴加过量的BaCl2溶液,出现白色沉淀,再加入过量的稀硝酸,沉淀部分消失并产生气泡.则此固体粉末中一定含有的杂质是______.
(3)取步骤(2)实验后的上层清液,加入稀硝酸、硝酸银溶液,出现白色沉淀,由此该同学得出此固体粉末中一定含有NaCl,你认为此结论是否正确______(填“是”或“否”).
(4)对于是否含有NaCl,你认为应对步骤(2)作如何改进______(若步骤(3)填“是”,此空不作答).
-
实验室有一包白色粉来,可能含有CaCO3、BaCl2、Na2SO4、NaOH和NaCl中的一种或几种,为了确定其成分,某化学兴趣小组进行了如下探究。
(查阅资料)
BaSO4固体不溶于水,也不溶于稀盐酸。
(实验探究)
甲同学设计了如下的实验方案。
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量该粉末于试管中,加入足量水充分溶解 | 有白色沉淀 | 原粉末中一定含有碳酸钙 |
| b.将步骤a试管中物质过滤,向滤液中滴加酚酞溶液 | 溶液变红 | 原粉末中一定含有_____ |
乙同学认为甲同学步骤a的结论不一定正确,其理由是_____(用化学方程式表示),他补充了如下实验,取白色沉淀于试管中,加入足量稀盐酸,观察到有气泡产生且_____,从而得出结论:步骤a中得到的白色沉淀全部是 CaCO3。丙同学取甲同学步b中已变红的溶液,向其中逐滴滴入稀硫酸,发现有白色沉淀生成溶液褪色。溶液褪色的原因用化学方程式表示为_____。
(总结归纳)
通过以上探究,原白色粉末中无法确定的成分是_____。
-
现有一包K2CO3样品,可能含有CuSO4、CaCl2、Na2CO3、NaCl、NaOH中的一种或几种。现做如下实验:

(1)根据以上实验可以判断,白色固体中一定不含________、_________,一定含有___________。
(2)为进一步确定可能含有的物质:
①取步骤Ⅰ所得无色澄清溶液适量,滴加AgNO3溶液,有白色沉淀,再加入足量稀HNO3,沉淀部分溶解,则此粉末中一定含有的杂质是_____________。
②为确定Na2CO3,称取6.9g样品,滴加过量的稀盐酸,充分反应后,测得生成CO2气体质量2.4g,则说明一定还含有Na2CO3,你认为此结论_________(选填“是”或“否”)正确。
-
有一包白色固体,可能含有Ba(NO3)2、NaCl、CaCO3、NaOH、CuSO4中的一种或几种。为确定其组成,进行下列实验。请根据实验现象判断:
(1)取样,溶于足量水中,搅拌、过滤,得到无色澄清溶液A和沉淀B。
(2)取沉淀B,加入过量稀HNO3,沉淀全部溶解,有气泡产生,同时得到蓝色溶液。则此固体中一定无_______,请写出得到蓝色溶液化学方程式_____________。
(3)取无色溶液A,测得pH>7,由(1)(2)(3)可知溶液A中一定含有的溶质有_______。
(4)为确定可能含有的物质,另取少量溶液A,先加入足量______溶液,过滤,在滤液中加入足量的稀硝酸后,再滴加________溶液,根据现象即可判断。
-
有一包白色固体,可能含有 NaOH 、NaCl 、K2SO4、Na2CO3、CuSO4中的几种。为确定其组成,进行下列实验。请根据实验现象判断:
(1)取试样溶于水,得无色澄清溶液A,则此固体中一定没有___;
(2)溶液A中加入足量Ba(NO3)2溶液,产生白色沉淀B,上层清液中滴加酚酞变红,则此固体中一定含有___;
(3)取白色沉淀B加入过量的稀硝酸,沉淀部分消失。则原固体中一定还含有___、___。写出沉淀溶解的化学方程式___ 。
-
有一包白色固体,可能含有Ba(NO3)2、NaCl、CaCO3、Na2SO4,NaOH、CuSO4中的一种或几种。为确定其组成,进行下列实验。请根据实验现象判断:
①取样,溶于足量水中,搅拌、过滤,得到无色澄清溶液A和14.9g沉淀B。
②向14.9g沉淀B中加过量稀HNO3.沉淀全部溶解。有气泡产生并测得气体质量为 4.4g,同时得到蓝色溶液。在澄清溶液A中,加足量 BaCl2溶液,经过滤、洗涤、干燥,得固体23.3g。
(1)此固体中一定含______,一定不含______,可能含有______。
(2)得到蓝色溶液化学方程式为______。
(3)为确定原固体中可能含有的物质,测定溶液A的pH>7,取少量溶液A,先加入足量__溶液,过滤,在滤液中加入足量的稀硝酸后,再滴加__溶液,根据现象即可判断。




