-
某学生毕业回乡后,利用所学化学知识科学致富。他运用当地盛产的石灰石(主要成分碳酸钙)来煅烧,生产生石灰(主要成分氧化钙)。反应的化学方程式为:CaCO3 CaO + CO2 ↑。
CaO + CO2 ↑。
请计算回答:
(1)碳酸钙(CaCO3)的相对分子质量为 ;
(2)CaO中钙元素与氧元素的质量比为 ;
(3)CaCO3中,钙元素的质量分数为 %;
(4)假如煅烧含碳酸钙80%的石灰石250t,可生产出多少t含氧化钙90%的生石灰? (保留一位小数点)
【解析】(1)碳酸钙(CaCO3)的相对分子质量为:40+12+16*3=100
(2)CaO中钙元素与氧元素的质量比为:40:16
(3)CaCO3中,钙元素的质量分数为40/100*100%=40%
(4)已知含碳酸钙80%的石灰石250t,据此就可以求出氧化钙了,具体步骤见答案。
-
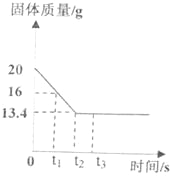
工业上利用煅烧石灰石的方法生产生石灰(主要成分是氧化钙),同时得到二氧化碳。化学兴趣小组为测定一批石灰石样品中碳酸钙的质量分数,取用20g石灰石样品,进行高温煅烧(样品除碳酸钙外,其余成分高温不分解)。测得石灰石煅烧过程中固体质量与反应时间的关系如图所示。请回答下列问题:
(1)该由图象可知,当时间为_____之后,石灰石已完全分解;
(2)最终生成二氧化碳的质量为_____;
(3)计算该石灰石中碳酸钙的质量分数_____(要求写出计算过程)。
-
超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:

(1)石灰石主要成分是碳酸钙,在石灰窑中煅烧石灰石的化学方程式为_____________________;
(2)乳化池中,生石灰与水发生反应,这个反应过程中会_________(填“吸收”或“放出”)热量, 这个反应的基本反应类型为_____________________________;
(3)碳化塔中反应的化学方程式为__________________________________。
-
超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:

(1)石灰石主要成分是碳酸钙,在石灰窑中煅烧石灰石的化学方程式为_____________________;
(2)乳化池中,生石灰与水发生反应,这个反应过程中会_________(填“吸收”或“放出”)热量, 这个反应的基本反应类型为_____________________________;
(3)碳化塔中反应的化学方程式为__________________________________。
-
(1)在牙膏中,常用轻质碳酸钙粉末作摩擦剂.人们通常用下列方法生产轻质碳酸钙: ①将石灰石[主要成分为碳酸钙]煅烧制得氧化钙,②再将氧化钙加水制成石灰乳[主要成分是Ca(OH)2],③将净化后的石灰乳与二氧化碳作用得到碳酸钙。其中第①步中发生反应的化学方程式是_____,属于_____反应;第③步反应的化学方程式是_____,第②步属于_____反应。
(2)燃料的燃烧在人类社会的发展过程中起着相当重要的作用。从环境保护的角度考虑,在煤气、沼气[即甲烷(CH4)]和氢气中,首选的燃料是_____,写出该气体燃烧的化学方程式_____;煤气的主要成分是CO,其燃烧的化学方程式为_____。
-
工业上制取二氧化碳,是利用高温煅烧石灰石,使石灰石的主要成分碳酸钙(CaCO3)分解,制得生石灰(CaO)和二氧化碳.如果要制取5.6t氧化钙,需要碳酸钙的质量多少?
-
高温煅烧石灰石,其主要成分是碳酸钙(CaCO3),可制得氧化钙.其反应的化学方程式为:CaCO3 CaO+CO2↑,若高温煅烧100吨石灰石,可得到氧化钙多少吨?
CaO+CO2↑,若高温煅烧100吨石灰石,可得到氧化钙多少吨?
-
在牙膏中,常用轻质碳酸钙粉末作摩擦剂。人们通常用下列方法生产轻质碳酸钙:将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳(主要成分是Ca(OH) 2),然后将净化后的石灰乳与二氧化碳作用得到碳酸钙。试用化学方程式表示上述反应的原理_______。
-
(8分)用作牙膏摩擦剂的轻质碳酸钙可以石灰石来制备,工业上主要生产流程如下,请回答:
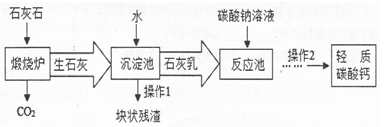
(1)写出下列物质或主要成分的化学式:生石灰 ,石灰乳 。
(2)“煅烧炉”中发生反应的化学方程式是: 。
在“反应池”中主要发生反应的化学方程式是: 。
(3)从反应池中分离出轻质碳酸钙的方法是 。
(4)有人建议在上述流程中用煅烧炉排出的CO2气体替代“碳酸钠溶液”,这样做的优点是:
。(任写1点)
-
用作牙膏摩擦剂的轻质碳酸钙可以石灰石来制备,工业上主要生产流程如下,请回答:
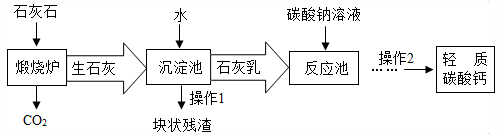
(1)写出下列物质或主要成分的化学式:生石灰_________,石灰乳_________。
(2)“煅烧炉”中发生反应的化学方程式是:________________________。在“反应池”中主要发生反应的化学方程式是:___________________。
(3)从反应池中分离出轻质碳酸钙的方法是__________________。
(4)有人建议在上述流程中用煅烧炉排出的CO2气体替代“碳酸钠溶液”,这样做的优点是:_______________________。(任写1点)
CaO + CO2 ↑。




