-
工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
(查阅资料)(1)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4•3H2O  CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
(3)铁的常见氧化物中铁的质量分数:
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
(问题讨论)为了测定铁红中铁的质量分数,小组间进行如下实验。(装置气密性良好)

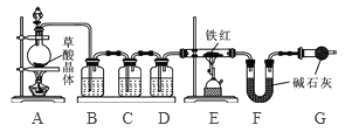
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是________(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)C装置的作用是 __________________________。
(3)写出E装置中所发生反应的一个化学方程式: _____________________。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 ____ < m < ______。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是 _________。
(实验反思) (1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会 ________(选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是 ___________________。
-
工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
【查阅资料】(1)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4•3H2O  CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
(3)铁的常见氧化物中铁的质量分数:
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
【问题讨论】为了测定铁红中铁的质量分数,小组间进行如下实验。(装置气密性良好)
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是________(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)C装置的作用是 __________________________。
(3)写出E装置中所发生反应的一个化学方程式: _____________________。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 ____ < m < ______。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是 _________。
【实验反思】 (1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会 ________(选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是 ___________________。
-
工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
【查阅资料】(1)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4•3H2O  CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
(3)铁的常见氧化物中铁的质量分数:
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
【问题讨论】为了测定铁红中铁的质量分数,小组间进行如下实验。(装置气密性良好)

(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是________(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)C装置的作用是 __________________________。
(3)写出E装置中所发生反应的一个化学方程式: _____________________。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 ____ < m < ______。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是 _________。
【实验反思】 (1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会 ________(选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是 ___________________。
-
工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
【查阅资料】
1.草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:
H2C2O4•3H2O  CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
2.碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
3.铁的常见氧化物中铁的质量分数:
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
【问题讨论】为了测定铁红中铁的质量分数,小组间学进行如下实验。(装置气密性良好)

(1) 该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是 (填字母序号)
A.浓硫酸 B.澄清的石灰水 c氢氧化钠溶液
(2)C装置的作用是 。
(3)写出E装置中所发生反应的一个化学方程式: 。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 <m< 。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是 。
【实验反思】
(1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会 (选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是 。
-
工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
【查阅资料】
1.草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:
H2C2O4•3H2O  CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
2.碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
3.铁的常见氧化物中铁的质量分数:
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
【问题讨论】为了测定铁红中铁的质量分数,小组间学进行如下实验。(装置气密性良好)

(1) 该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是 (填字母序号)
A.浓硫酸 B.澄清的石灰水 c氢氧化钠溶液
(2)C装置的作用是 。
(3)写出E装置中所发生反应的一个化学方程式: 。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 <m< 。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是 。
【实验反思】
(1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会 (选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是 。
-
工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4。
[查阅资料]①草酸晶体(H2C2O4·3H2O)在浓硫酸作用下受热分解,化学方程式为:
②碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
③铁的常见氧化物中铁的质量分数:
[问题讨论]为了测定铁红中铁的质量分数,小组间学生进行如下实验。

(1)实验前应先连接好仪器并_____。
(2)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是_____(填字母序号)。
a.浓硫酸
b.澄清的石灰水
c.氢氧化钠溶液
(3) C装置的作用是_____。
(4)写出E装置中所发生反应的一个化学方程式:_____。
(5)称取铁红样品1.0用上述装置进行实验,若实验价后称得F装置增重7.7g.则此铁红中铁元素的质量分数是_____。
[实验反思]
(1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会_____(选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是_____。
-
工业铁红可用于生产颜料,其主要成分是 Fe2O3,还含有少量的FeO、Fe3O4。为了测定某种工业铁红样品中铁元素的质量分数,同学们进行了如下探究。
(查阅资料)
Ⅰ.草酸晶体(H2C2O4•3H2O)在浓硫酸的催化下受热分解,会生成二氧化碳、一氧化碳和水。
Ⅱ.碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳
Ⅲ.铁的常见氧化物中,铁元素的质量分数如下表所示:
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁元素的质量分数 | 77.8% | 70.0% | 72.4% |
(设计与实验)小组同学设计了下图所示实验装置:
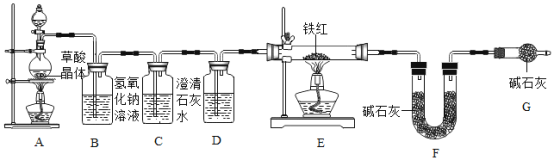
(1)为了保证进入E 中的气体是纯净、干燥的 CO,则 D 中的试剂名称为_____。
(2)C 装置的作用是_____。
(3)写出E 装置中发生反应的化学方程式(一个即可):_____。
(4)同学们称取 10.0g 铁红样品进行实验,根据资料信息推算,理论上铁红样品中铁元素质量的取值范围是_____。利用上述装置进行实验(装置气密性良好),并通过以下两种方法得出测定结果。
方法一:充分反应后,称量E 中得到的铁粉的质量,经计算求出铁元素的质量分数。
方法二:分别称量实验前后_____(填字母序号)装置的质量,经计算求出铁元素的质量分数。
(实验反思)
(1)如果缺少G 装置(不考虑其他因素),可能会导致利用方法二测定的样品中铁元素的质量分数偏小,原因是_____。
(2)从绿色化学的角度考虑,该实验装置的不足之处是_____。
-
请你参与兴趣小组的探究活动。
【提出问题】铁红中铁的质量分数是多少?(已知:工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。)
【查阅资料】
①草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4·3H2O CO2↑+ CO↑+ 4H2O
CO2↑+ CO↑+ 4H2O
②浓H2SO4是液体,能有效吸收水分。
③碱石灰是氧化钙和氢氧化钠的混合物。
④一般来说,氢氧化钠溶液吸收二氧化碳的效果比氢氧化钙溶液好。
⑤铁的常见氧化物中铁的质量分数:

【实验与讨论】
(1)下列不能用作草酸分解制取气体的装置是 (填字母编号)。

(2)用下图所示装置进行实验,实验前应先 。

(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是 、 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)B装置的作用是 ,发生的化学方程式是
(5)写出D装置中含量最多的固体物质所发生反应的化学方程式 。
【数据分析与计算】
称取铁红样品20.0 g,用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为m g,则 < m < 。
② 实验前后称得E装置增重13.2g,则此铁红中铁的质量分数是 。
【实验评价】
请指出图21-2中实验装置的一个明显缺陷 。
-
探究一:工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某兴趣小组用草酸晶体制取CO,并进行了如下图所示实验。试回答:
【查阅资料】草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解生成CO2和CO。

(1)实验前应先________。
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是________、C中的试剂是________(填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)F装置的作用是________。
(4)某同学认为图示装置有不足之处,改进的方法是________。
-
工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁元素的质量分数,某兴趣小组的同学利用草酸晶体(H2C2O4·3H2O)分解产生的气体进行了如下实验。
(资料)草酸晶体(H2C2O4·3H2O)在浓硫酸的催化作用下受热分解,化学方程式为:
H2C2O4·3H2O CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
碱石灰的成分是氢氧化钠和氧化钙,是一种良好的固体干燥剂。
(问题探究)用下图所示装置进行实验:(装置气密性良好,各装置内所装试剂均足量)

关于该实验有下列说法:
①用草酸晶体制取一氧化碳的发生装置与过氧化氢制取氧气的发生装置相同
②进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是浓硫酸和氢氧化钠溶液
③对D装置加热前和停止加热后,都要通入CO,其作用都是防止爆炸
④F装置的作用是防止空气中的二氧化碳和水蒸气进入E装置
⑤若取铁红样品的质量为m,充分反应后D中玻璃管内的固体质量减少了n,则样品中铁元素的质量分数为 ×100%
×100%
⑥若取铁红样品的质量为a,充分反应后E装置内固体的质量增加了b,则样品中中铁元素的质量分数为 ×100%
×100%
⑦实验装置有一明显的缺陷是没有尾气处理装置
以上说法正确的是( )
A. ①②⑦ B. ④⑥⑦ C. ④⑤⑦ D. ③⑤⑥
CO2↑+CO↑+H2O











