-
下列说法正确的是 ( )
A.明矾水解形成的Al(OH)3胶体能杀菌消毒,可用于水的净化
B.镀锡的铁制品比镀锌的铁制品耐腐蚀
C.pH=6的某溶液一定呈酸性
D.二次电池充电时,电池上标有“+”的电极应与外接电源的正极相连
难度: 中等查看答案及解析
-
下列微粒的核外电子的表示方法中正确的是
A.碳原子轨道表示式

B.P原子价电子轨道表示式
C.Cr原子的价电子排布式3d44s2
D.Fe2+价电子排布式3d44s2
难度: 中等查看答案及解析
-
下列事实中不能证明CH3COOH是弱电解质的是
①常温下某CH3COONa溶液的pH=8 ②醋酸能与水以任意比例互溶 ③等pH、等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多 ④0.1 mol·L-1 CH3COOH溶液的pH=2.1 ⑤在相同条件下,醋酸溶液的导电性比同浓度盐酸弱 ⑥1mol/L的醋酸溶液10mL恰好与10mL1mol/L的NaOH溶液完全反应
A.②⑥ B.②⑤ C.①③⑤ D.③④⑤⑥
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述中正确的是
A.1L 0.1 mol/L Na2SO3溶液中的阴离子的浓度小于0.1 NA
B.25 ℃,1LpH=7的NH4Cl和NH3·H2O的混合溶液中,含OH—的数目为10-7NA
C.一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移的电子数为0.2NA
D.电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4 g
难度: 中等查看答案及解析
-
已知常温下某二元酸发生如下电离:H2A=H++HA-;HA-
H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
A.NaHA溶液呈酸性,因为HA-的电离程度大于水解程度
B.常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的108倍
C.常温下pH=2的H2A溶液中c(A2-)小于c(HA-)
D.0.1mol/LH2A溶液中c(A2-)+c(HA-)+c(H2A)=0.1mol/L
难度: 困难查看答案及解析
-
由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是
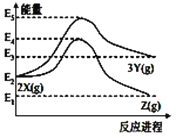
A.由 X→Z 反应的 ΔH > 0
B.由 X→Y 反应的 ΔH=E5 -E2
C.升高温度有利于提高 Z 的产率
D.降低压强有利于提高 Y 的产率
难度: 简单查看答案及解析
-
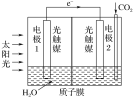
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是
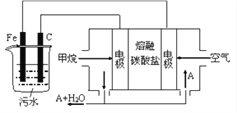
A. 石墨电极上发生氧化反应 B. 通甲烷的电极反应式:CH4+4CO32--8e-=5CO2+2H2O
C. 通空气的电极反应式为O2+4e-=2O2- D. 甲烷燃料电池中CO32-向空气一极移动
难度: 困难查看答案及解析
-
反应mA(s)+ nB(g)
eC(g)+ fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是
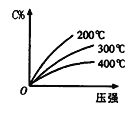
A.达到平衡后,加入催化剂则C%增大
B.达到平衡后,增加A的量有利于平衡向正向移动
C.化学方程式中n>e+f
D.达到平衡后,若升温,平衡正向移动
难度: 中等查看答案及解析
-
常温下,电解质溶液的性质与变化是多样的,下列说法正确的是
A.往稀氨水中加水,溶液中的
值变小
B.pH相等的①CH3COONa、②NaClO、③NaOH三种溶液中c(Na+)大小:①>②>③
C.pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)=c(OH-)+2c(S2-)
D.Ca(ClO)2溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强
难度: 中等查看答案及解析
-
室温时,下列关于各溶液的叙述中正确的是
A.将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀
B.实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的时间间隔相同
C.向0.1 mol·L-1醋酸和饱和硼酸溶液中滴加等浓度的碳酸钠溶液,均有气体产生
D.0.10 mol·L-1 CH3COONa溶液中通入HCl至溶液的pH恰好等于7,则c(Na+)>c(CH3COOH)=c(Cl-)
难度: 中等查看答案及解析
-
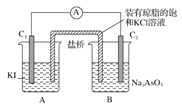
电解Na2CO3溶液制取NaHCO3溶液和NaOH溶液的装置如下图所示。下列说法中,不正确的是
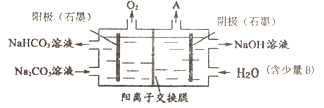
A. 阴极产生的物质A是H2
B. 物质B是NaCI,其作用是增强溶液导电性
C. 阳极OH-放电,H+浓度增大,CO32-转化为HCO3-
D. 溶液中Na+由阳极室向阴极室迁移
难度: 中等查看答案及解析
-
如图所示与对应叙述相符的是
A.图
 表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则 Ksp(FeS)<Ksp(CuS)
表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则 Ksp(FeS)<Ksp(CuS)B.图
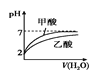 表示等体积的pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
表示等体积的pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸C.某温度下向20 mL 0.1 mol·L-1的CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,pH变化曲线如图所示
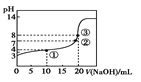 (忽略温度变化),则①点(CH3COO—)>c(Na+)>c(CH3COOH)
(忽略温度变化),则①点(CH3COO—)>c(Na+)>c(CH3COOH)D.图
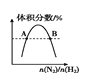 表示反应N2(g)+3H2(g)
表示反应N2(g)+3H2(g)2NH3(g)平衡时NH3体积分数随起始 n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
难度: 中等查看答案及解析
-
下列实验能达到实验目的的是______ 。
序号
实验内容
实验目的
A
盛有
酸性溶液的两只试管,一只加入
溶液,另一只加入
溶液
探究浓度对反应速率的影响
B
用石墨电极电解
、
的混合液
比较确定铜和镁的金属活动性强弱
C
在容积可变的密闭容器中发生反应:2NO2(g)
N2O4(g),把容器的体积缩小一半
正反应速率加快,逆反应速率减慢
D
向2支试管中各加入相同体积、相同浓度的
3溶液,再分别加入不同体积相同浓度的稀硫酸,分别放入冷水和热水中
探究温度对反应速率的影响
A.A B.B C.C D.D
难度: 中等查看答案及解析