-
化学与生活、生产、社会可持续发展密切相关,下列说法错误的是( )
A.用灼烧闻气味的方法可区别棉织物和纯毛织物
B.《本草纲目》记载“用浓酒和糟入甑,蒸令气上,用器承滴露”,其原理与蒸馏相同
C.用聚氯乙烯代替木材生产快餐盒,可减少木材的使用
D.用来制作N95口罩“熔喷布”的原料聚丙烯是混合物
难度: 简单查看答案及解析
-
按系统命名法,下列有机物的命名正确的是( )
A.2,4,4-三甲基戊烷 B.2-乙基-1-丁烯
C.2-甲基-3-戊炔 D.2,2-二甲基-3-丁醇
难度: 简单查看答案及解析
-
下列关于原子结构与元素周期表的说法正确的是( )
A.电负性最大的元素位于周期表的左下角
B.基态原子最外层电子排布为ns2的元素都位于周期表IIA族
C.某基态原子的电子排布式为[Ar]3d104s24p1,该元素位于周期表第四周期IIIA族
D.基态原子p能级电子半充满的原子第一电离能一定大于p能级有一对成对电子的
难度: 简单查看答案及解析
-
关于实验室中的仪器①试管、②烧杯、③容量瓶、④量筒、⑤分液漏斗、⑥滴定管、⑦蒸馏烧瓶、⑧蒸发皿,下列说法错误的是( )
A.能直接加热的有①⑧
B.常用于物质分离的有⑤⑦⑧
C.使用前应进行检漏的有③⑤⑥
D.标有使用温度的有③④⑥⑦
难度: 简单查看答案及解析
-
已知某种锂盐的结构如图,它是一种新型锂离子电池的电解质,其阴离子由W、X、Y、Z四种同周期主族元素构成,Y原子的最外层电子数是X的次外层电子数的3倍(箭头指向表示共用电子对由W提供)。下列说法错误的是( )

A.元素非金属性强弱顺序是W>Y>Z>X
B.阴离子中X与Z的杂化方式相同
C.原子半径X>Z>Y>W
D.该物质中含有极性键、非极性键、配位键和离子键
难度: 中等查看答案及解析
-
法匹拉韦(Favipiravir)是一种RNA聚合酶抑制剂,被用于治疗新型和复发型流感,主要通过阻断病毒核酸复制的方法抑制病毒增殖,其结构如图。下列关于法匹拉韦的说法错误的是( )
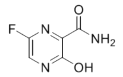
A.分子式为C5H4FN3O2
B.所有原子可能在同一平面上
C.所有碳原子的杂化方式都是sp2杂化
D.一定条件下能与氢氧化钠溶液、盐酸、氢气等发生反应
难度: 中等查看答案及解析
-
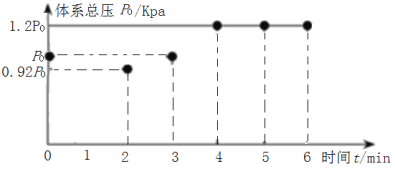
我国有世界储量第一的天然石膏(主要成分CaSO4),同时也有大量磷酸工业副产品石膏,可用于硫酸及水泥的联合生产。硫酸钙在高温下被CO还原,发生的反应有:
I.CaSO4(s)+4CO(g)⇌CaS(s)+4CO2(g) K1
II.CaSO4(s)+CO(g)⇌CaO(s)+SO2(g)+CO2(g) K2
III.3CaSO4(s)+CaS(s)⇌4CaO(s)+4SO2(g) K3
上述反应的平衡常数的对数值(lgK)与温度(T)的关系如图所示。下列说法错误的是( )
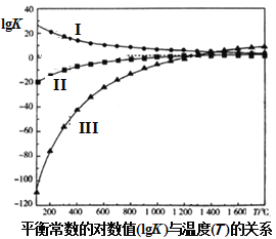
A.反应II的△H>0
B.lgK3=4lgK2−lgK1
C.使用适当的催化剂能够加快反应速率,提高原料的平衡转化率
D.调控适当的温度可以抑制反应I促进反应III而得到较纯净的CaO
难度: 中等查看答案及解析
-
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
被提纯的物质
除杂试剂
分离方法
A
甲烷(乙烯)
酸性高锰酸钾溶液
洗气
B
苯(苯酚)
氢氧化钠溶液
分液
C
乙酸乙酯(乙酸)
氢氧化钠溶液
分液
D
乙醇(水)
氯化钙
蒸馏
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
碳酸亚铁是白色难溶于水的固铁剂。某小组利用如图装置,向装置③中通入CO2至溶液pH=7,然后滴入FeSO4溶液,过滤、洗涤、干燥制得FeCO3。
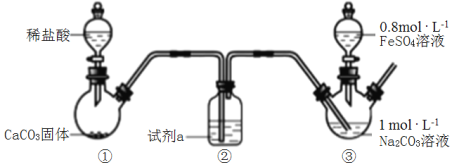
下列说法错误的是( )
A.试剂a是饱和NaHCO3溶液
B.碳酸钠溶液通入CO2至pH=7的目的是降低c(OH-),防止生成Fe(OH)2
C.装置③中生成沉淀的离子方程式为Fe2++CO
=FeCO3↓
D.碳酸钠溶液显碱性的原因是CO
+H2O⇌HCO
+OH-
难度: 中等查看答案及解析
-
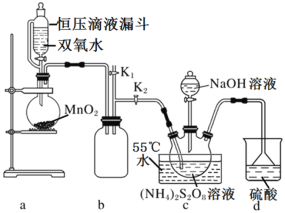
MnO2在电池、玻璃、有机合成等工业生产中应用广泛。利用粗MnO2(含有杂质MnO和MnCO3)制取纯MnO2的流程如图。
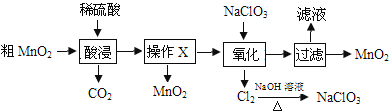
下列说法错误的是( )
A.酸浸过程中稀硫酸可用稀硝酸、稀盐酸代替
B.操作X的名称是过滤
C.氧化过程发生反应的离子方程式为5Mn2++2ClO
+4H2O=5MnO2↓+Cl2↑+8H+
D.电解MnSO4溶液也可制得MnO2,阳极电极式为Mn2+-2e-+2H2O=MnO2↓+4H+
难度: 中等查看答案及解析
-
我国科学家设计CO2熔盐捕获与转化装置如图1,可与太阳能电池(装置如图2)联合实现绿色转化。下列有关说法错误的是( )
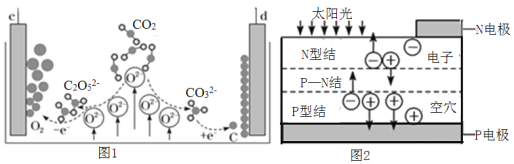
A.c接太阳能电池的P电极
B.CO2与熔盐发生氧化还原反应生成CO32-和C2O52-
C.d极电极反应式为CO32-+4e-=C+3O2-
D.理论上转移4mol电子可捕获标准状况下CO222.4L
难度: 中等查看答案及解析
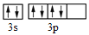 ,是因为该排布方式违背了___。
,是因为该排布方式违背了___。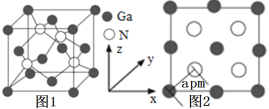
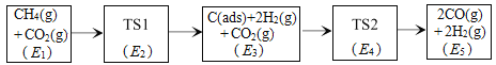
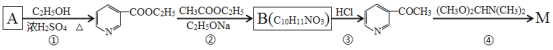
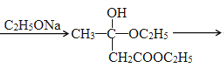 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH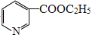 有多种同分异构体,其中含有苯环的硝基化合物有___种,写出其中一种具有手性碳的同分异构体的结构简式为___。
有多种同分异构体,其中含有苯环的硝基化合物有___种,写出其中一种具有手性碳的同分异构体的结构简式为___。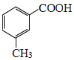 为原料合成
为原料合成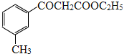 的合成路线(其它试剂任选)___。
的合成路线(其它试剂任选)___。