-
过硫酸钠(Na2S2O8)也叫高硫酸钠、过二硫酸钠,是白色晶状粉末,易溶于水,加热至65℃就会发生分解,用作漂白剂、氧化剂、乳液聚合促进剂。某化学小组对Na2S2O8制备和性质进行探究。
I.实验室制备Na2S2O8
(查阅资料)工业制备过硫酸钠的反应原理:
主反应:(NH4)2S2O8+2NaOH Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2NH3+3Na2S2O8+6NaOH 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
设计如图实验装置:
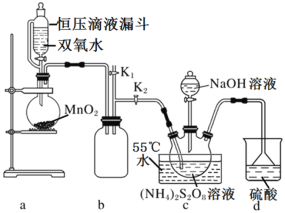
(1)恒压滴液漏斗的优点是___。
(2)装置a中反应产生的气体需要持续通入装置c的目的是___;装置b、d的作用分别是___、___。
(3)反应完毕,将三颈圆底烧瓶中的溶液减压浓缩、结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是___。
II.探究Na2S2O8的性质
(1)酸性过硫酸钠溶液,在Ag+催化作用下可以把Mn2+氧化为MnO4-,该方法可用于检验Mn2+,所得溶液除去Ag+后加入BaCl2溶液可以产生白色沉淀。
①用酸性Na2S2O8溶液检验Mn2+时的实验现象为___。
②该反应的离子方程式为____。
(2)过硫酸钠溶液与铜反应只生成两种盐且反应先慢后快,某同学推测反应先慢后快的原因可能是生成的Cu2+对反应起催化作用,设计实验方案检验该推测是否正确___。(供选择试剂:Cu、Na2S2O8溶液、Na2SO4溶液、CuSO4溶液、Cu(NO3)2溶液、CuCl2溶液、蒸馏水)
-
保险粉又称连二亚硫酸钠(Na2S2O4),可用于纺织工业的漂白剂、脱色剂,脱氯剂。Na2S2O4是白色粉末,无味,易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定。
Ⅰ.甲酸钠( HCOONa) 法制备过程如下:

(1)连二亚硫酸钠中硫元素的化合价为______________。
(2)实验室用Na2SO3 固体和某酸反应制备SO2气体,制备SO2时所选用的酸,你认为下列最适宜选用的是______________。
A.浓盐酸 B.浓硝酸
C.质量分数为70%的硫酸 D.质量分数为10%的硫酸
(3)步骤①中制备连二亚硫酸钠的化学方程式可表示为____________________________。
(4)上述步骤②中,加入适量乙醇水溶液的作用是______________。
(5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是_________________________。
(6)①现将0.05mol/L Na2S2O4溶液在空气中放置,其溶液的pH 与时间(t)的关系如图所示。

t1时溶液中只有NaHSO3一种溶质,此时含硫元素的粒子浓度由大到小的顺序为_______________。
②t1~t2段发生化学反应的离子方程式为______________________________。
Ⅱ.电解法制备:工业上用惰性电极电解NaHSO3溶液得到Na2S2O4。过程如图所示
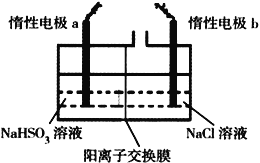
(7) ①产品在_________________(填“阳极”、“阴极”)得到。
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是__________________________________。
-
过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).
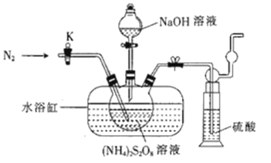
已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2 )。
)。
-
过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).
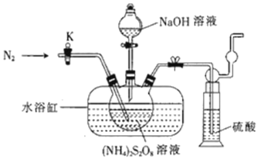
已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2 )。
)。
-
连二亚硫酸钠(Na2S2O4)俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4在潮湿空气中氧化,生成的两种常见酸式盐是___(填化学式)。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
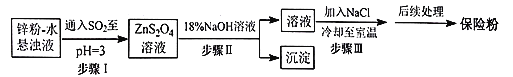
①工业上常将锌块进行预处理得到锌粉-水悬浊液,其目的是__。
②步骤Ⅰ中发生反应的化学方程式为__。
③在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是__,“后续处理”最终要加入少量的Na2CO3固体,其原因是__。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的离子方程式是___。
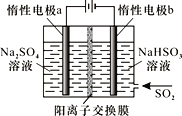
(4)有人设计了图示方法同时制备连二亚硫酸钠和过二硫酸钠(Na2S2O8),并获得中国专利。电解过程中,阴极室生成Na2S2O4,a极的电极反应式为__,通过阳离子交换膜的离子主要是Na+,其迁移方向是__(填“a到b”或“b到a”)。
-
过二硫酸钾(K2S2O8)是一种无色结晶,不溶于乙醇,有强氧化性,易分解。实验室制备过二硫酸钾可通过低温电解KHSO4认溶液得到。
实验步骤如下:
步骤1.称取40gKHSO4溶解90mL蒸馏水,倒入大试管,试管浸在冰水浴中(装置见图9),并冷却到5℃以下。
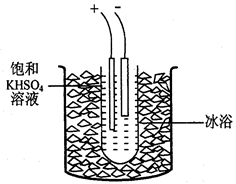
步骤2电解2h,每隔约半小时补一次冰
步骤3.将沉淀收集在漏斗中,直接用乙醇和乙醚洗涤和过滤
步骤4.干燥、称重
步骤5.回收乙醚和乙醇
(1)电解总反应的化学方程式为________。
(2)电解过程中,阳极产生微量且能使湿润的KI-淀粉变蓝的有色单质气体,该气体可能是(填化学式)。
(3)步骤2每隔半小时要向大烧杯添加冰块,其原因是。
(4)步骤5回收乙醇、乙醚时采用的操作方法是________。
(5)取得到的样品0.2500g溶于30mL水,加4gKI,塞住瓶塞,振荡,静止15min,加入1mL冰醋酸,再用cmol·L- 1Na2S2O3溶液滴定。(S2O82- +3I- =2SO42- +I3-;I3- I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)
①溶解时,加入KI后需塞住瓶塞,其目的是________。
②本实验所用的指示剂为________。
③若本次滴定消耗Na2SO3溶液VmL,由本次结果计算,样品中K2S2O8的纯度为(用含c、V的代数式表示)。
(6)分析化学上检验Mn2+在Ag+催化下K2S2O8溶液将Mn2+氧化为紫色的MnO4-,该反应的离子方程式为 。
-
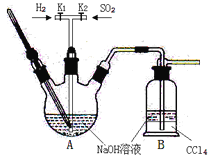
焦亚硫酸钠(Na2S2O5:M=190 g·mol-1)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。焦亚硫酸钠(Na2S2O5)在实验室可用如图装置制备。
已知:2NaHSO3 Na2S2O5 + H2O S2O52-+2H+=2SO2↑+H2O
Na2S2O5 + H2O S2O52-+2H+=2SO2↑+H2O
(1)实验中如果SO2通入过多,会降低Na2S2O5的产率,试解释其原因__________。
(2)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法(杂质不与碘反应)。
已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+; 2S2O32-+I2 =S4O62-+2I-
称取0.2000 g产品放入碘量瓶中,加入40.00 mL 0.1000 mol·L-1的标准碘溶液,在暗处放置5 min,再加入适量冰醋酸及蒸馏水。用0.2000 mol·L-1的标准Na2S2O3溶液滴定剩余的碘至终点,重复操作3次,测得平均消耗标准Na2S2O3溶液20.00 mL。则产品中焦亚硫酸钠的质量分数为__________________。
(3)关于本实验的说法错误的是_________。
A.B装置中CCl4的作用是防止倒吸
B.滴定时,Na2S2O3溶液应该用碱式滴定管盛放
C.滴定终点的现象是刚好变蓝色
D.滴定时间过长会导致测得产品中焦亚硫酸钠的质量分数偏高
-
焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH + SO2 = Na2SO3 + H2O ……(a);
Na2SO3+ H2O + SO2 = 2NaHSO3 ……(b);
2NaHSO3 Na2S2O5 + H2O ……(c);
Na2S2O5 + H2O ……(c);
实验装置如下:
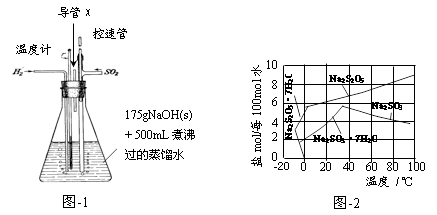
(1)实验室可用废铝丝与NaOH溶液反应制取H2,制取H2的离子方程式为 。
(2)图-1装置中,导管X的作用是 。
(3)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为 ;实验后期须保持温度在约80℃,可采用的加热方式为 。
(4)反应后的体系中有少量白色亚硫酸钠析出,参照图-2溶解度曲线,除去其中亚硫酸钠固体的方法是 ;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 。
(5)用图-3装置干燥Na2S2O5晶体时,通入H2的目的是 ;真空干燥的优点是 。
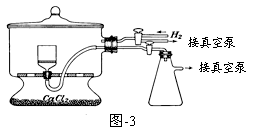
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2 = S4O62-+2I-
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。
④ 。
⑤ 。
⑥重复步骤①~⑤;根据相关记录数据计算出平均值。
-
焦亚硫酸钠(Na2S2O5)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH + SO2 = Na2SO3 + H2O……(a)
Na2SO3+ H2O + SO2 = 2NaHSO3 ……(b)
2NaHSO3  Na2S2O5 + H2O……(c)
Na2S2O5 + H2O……(c)
实验装置如下:

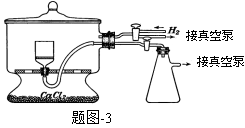
(1)实验室可用废铝丝与NaOH溶液反应制取H2,制取H2的离子方程式为 。
(2)题图-1装置中,导管X的作用是 。
(3)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓 慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为 ;
慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为 ;
实验后期须保持温度在约80℃,可采用的加热方式为 。
(4)反应后的体系中有少量白色亚硫酸钠析出,参照题图-2溶解度曲线,除去其中亚硫酸钠固体的方法是 ;然后获得较纯的无水Na2S2O5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是 。
(5)用题图-3装置干燥Na2S2O5晶体时,通入H2的目的是 ;真空干燥的优点是 。
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2 = S4O62-+2I-
请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。④ 。 ⑤ 。
⑥重复步骤①~⑤;根据相关记录数据计算出平均值。
-
过硫酸钠(Na2S2O8)常用作漂白剂、氧化剂等。某研究小组利用下图装置制备Na2S2O8并探究其性质(加热及夹持仪器略去)。
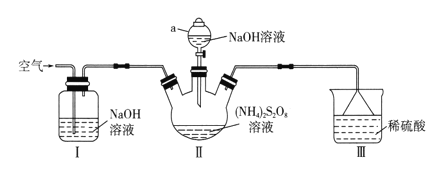
已知:①(NH4)2S2O8+2NaOH Na2S2O8+2NH3+2H2O
Na2S2O8+2NH3+2H2O
②2NH3+3Na2S2O8+6NaOH 6Na2SO4+N2+6H2O
6Na2SO4+N2+6H2O
(1)仪器a的名称是________________。装置I中NaOH溶液的作用是___________。
(2)装置II发生反应的同时,需要持续通入空气的目的是_______________________。
(3)装置III的作用是__________________________。
(4)Na2S2O8溶液与铜反应只生成两种盐,且反应先慢后快。
①该反应的化学方程式为___________________________。
②某同学推测反应先慢后快的原因可能是生成的Cu2+对反应起催化作用。设计实验方案验证该推测是否正确___________。(供选试剂:Cu、Na2S2O8溶液、CuSO4溶液、Cu(NO3)2溶液、蒸馏水)
(5)测定产品纯度:称取0.2500g样品,用蒸馏水溶解,加入过量KI,充分反应后,再滴加几滴指示剂,用0.1000mol/LNa2S2O8标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为19.50mL。(已知:I2+2S2O32-=S4O62-+2I-)
①选用的指示剂是____________;达到滴定终点的现象是______________________。
②样品的纯度为___________%。
Na2S2O8+2NH3↑+2H2O
6Na2SO4+6H2O+N2














