-
冰激凌中的奶油被称为人造脂肪,由液态植物油氢化制得。下列说法错误的是
A.奶油是可产生较高能量的物质 B.人造脂肪属于酯类物质
C.植物油中含有碳碳双键 D.油脂的水解反应均为皂化反应
难度: 简单查看答案及解析
-
下列物质分类正确的是
A.豆浆、蛋白质溶液均属于胶体 B.H2O、CO2均为电解质
C.NO、SO3均为酸性氧化物 D.H2S、O2常作还原剂
难度: 简单查看答案及解析
-
下列化学用语正确的是
A.中子数为2的氢原子:
H B.Na+的结构示意图:
C.OH-的电子式:[
H]一 D.N2分子的结构式:N—N
难度: 简单查看答案及解析
-
下列比较错误的是
A.与水反应的剧烈程度:K<Ca B.稳定性:HF>HC1
C.原子半径:Si>N D.碱性:Ca(OH)2> Mg(OH)2
难度: 简单查看答案及解析
-
下列做法中观察到的现象可以说明钠的密度比水小的是
A.用小刀切开金属钠 B.将钠放在坩埚中加热
C.把钠保存在煤油中 D.将钠放入盛水的烧杯
难度: 简单查看答案及解析
-
甲苯是重要的化工原料。下列有关甲苯的说法错误的是
A.分子中碳原子一定处于同一平面 B.可萃取溴水的溴
C.与H2混合即可生成甲基环己烷 D.光照下与氯气发生取代反应
难度: 简单查看答案及解析
-
在下列工业处理或应用中不属于化学变化原理的是
A.石油分馏 B.从海水中制取镁
C.煤干馏 D.用SO2漂白纸浆
难度: 简单查看答案及解析
-
下列有关氨气的制备、干燥、收集和尾气处理错误的是
A.
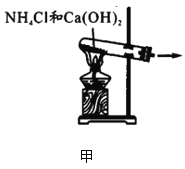 图甲:实验室制氨气 B.
图甲:实验室制氨气 B.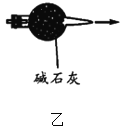 图乙:干燥氨气
图乙:干燥氨气C.
 图丙:收集氨气 D.
图丙:收集氨气 D. 图丁:实验室制氨气的尾气处理
图丁:实验室制氨气的尾气处理难度: 中等查看答案及解析
-
下列有机实验操作正确的是
A.证明CH4发生氧化反应:CH4通入酸性KMnO4溶液
B.验证乙醇的催化氧化反应:将铜丝灼烧至红热,插入乙醇中
C.制乙酸乙酯:大试管中加入浓硫酸,然后慢慢加入无水乙醇和乙酸
D.检验蔗糖在酸催化下的水解产物:在水解液中加入新制Cu(OH)2悬浊液,加热
难度: 中等查看答案及解析
-
下列解释对应事实的离子方程式正确的是
A.FeSO4溶液中滴加NaOH溶液,静置一段时间后:Fe2++2OH一=Fe(OH)2↓
B.漂白粉溶液加入醋酸:H++ClO-=HC1O
C.AgCl悬浊液滴入Na2S溶液:2Ag++S2-=Ag2S↓
D.K2 CrO4溶液滴入硫酸溶液;2CrO42-+2H+
Cr2O72-+H2O
难度: 中等查看答案及解析
-
教材中证明海带中存在碘元素的实验过程中,下列有关装置或操作错误的是
A.
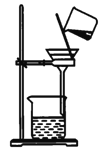 过滤 B.
过滤 B.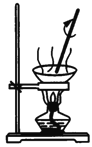 灼烧
灼烧C.
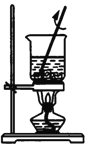 溶解 D.
溶解 D. 检验
检验难度: 简单查看答案及解析
-
在给定条件下,能顺利实现下列所示物质间直接转化的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
W、X、Y、Z均为短周期主族元素且原子序数依次增大。W最外层电子数是次外层电子数的3倍,W与Y同主族,X在短周期中原子半径最大。下列说法正确的是
A.常温常压下Y的单质为气态 B.X的氧化物是离子化合物
C.X与Z形成的化合物的水溶液呈碱性 D.W与Y具有相同的最高化合价
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,1molN2和3molH2催化反应后分子总数为2NA
B.100g98%的浓H2 SO4与过量的Cu反应后,电子转移数为NA
C.标准状况下,11.2L氧气和二氧化碳混合物中含氧原子数目为NA
D.1L1mol/LNa2CO3溶液中所含阴离子数目小于NA
难度: 中等查看答案及解析
-
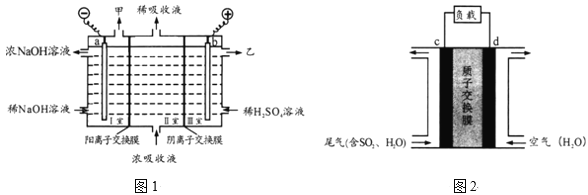
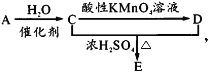
研究海水中金属桥墩的腐蚀及防护是桥梁建设的重要课题。下列有关说法错误的是
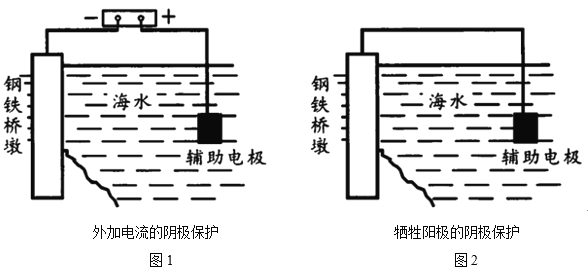
A.桥墩的腐蚀主要是析氢腐蚀
B.钢铁桥墩在海水中比在河水中腐蚀更快
C.图1辅助电极的材料可以为石墨
D.图2钢铁桥墩上发生的反应是O2+2H2O+4e一=4OH-
难度: 中等查看答案及解析
-
下列操作能达到实验目的的是
目的
实验操作
A
Al2O3有两性
将少量Al2O3分别加入盐酸和氨水中
B
浓硫酸有脱水性
蔗糖中加入浓硫酸,用玻璃棒充分搅拌
C
检验SO42-
向某溶液中滴加少量酸化的BaCl2溶液
D
检验Fe2+
向某溶液中滴入氯水,再滴入KSCN溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.0.1mol/L氨水中滴入等浓度等体积的醋酸,溶液导电性增强
B.适当升高温度,CH3COOH溶液pH增大
C.稀释0.1 mol/L NaOH溶液,水的电离程度减小
D.CH3COONa溶液中加入少量CH3COOH,
减小
难度: 中等查看答案及解析
-
在酸性条件下,黄铁矿( FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,实现该反应的物质间转化如图所示。下列分析错误的是
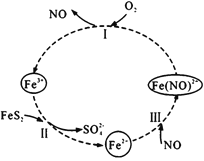
A.反应I的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O
B.反应Ⅱ的氧化剂是Fe3+
C.反应Ш是氧化还原反应
D.黄铁矿催化氧化中NO作催化剂
难度: 中等查看答案及解析
-
温度T℃时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g)
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
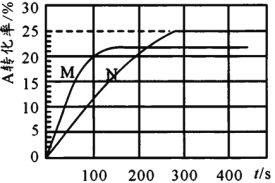
A.x可能为4
B.M为容器甲
C.容器乙达平衡时B的转化率为25%
D.M的平衡常数大于N
难度: 困难查看答案及解析
-
0.1 mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中的H2A、HA-、A2 -的物质的量分数δ(x)随pH的变化如图所示。下列说法错误的是
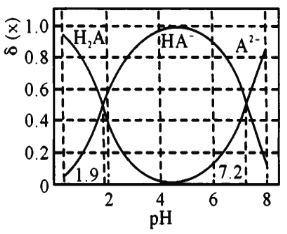
A.pH =1.9时,c(Na+)<c(HA-)+2c(A2-)
B.当c(Na+)=c(H2A)+c(HA-)+c(A2-)时,溶液pH>7
C.pH=6时,c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.lg[Ka2(H2A)]=-7.2
难度: 中等查看答案及解析