-
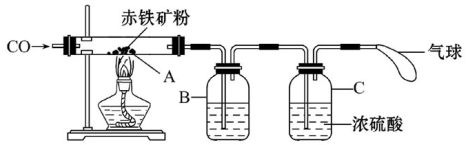
某化学小组探究炼铁的反应原理。
(一)利用图装置回答问题(假设赤铁矿粉样品中的Fe2O3完全反应,赤铁矿中杂质不参与反应):
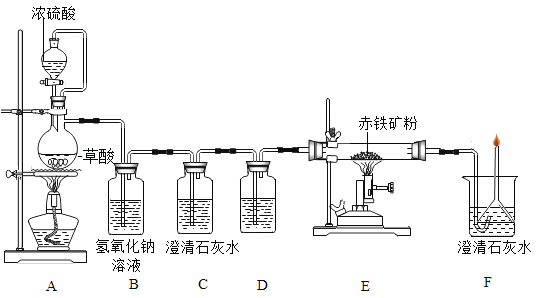
(1)A装置的作用是制取一氧化碳,反应的化学方程式为 。根据反应装置判断,化学方程式中还缺少的条件是___________________。
。根据反应装置判断,化学方程式中还缺少的条件是___________________。
(2)C装置的作用是______,D装置中药品的名称是________,E装置中发生反应的化学方程式为________,F处将尾气燃烧掉的目的是______。
(3)实验中记录的数据如下表,据此计算赤铁矿中氧化铁的质量分数为________。
| 玻璃管质量 | 玻璃管和药品反应前质量 | 玻璃管和药品反应后质量 |
| 65.6g | 75.6g | 73.2g |
(4)有同学提出可以根据F装置中增加的质量来计算赤铁矿中氧化铁的质量,你同意此看法吗?
说出你的观点和理由是_______。
(二)利用图装置进行甲、乙对比实验,探究温度对CO和Fe2O3反应的影响(固定装置和尾气处理装置略,所用固体药品为纯净物)。
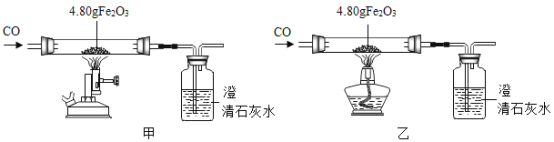
(1)反应过程中观察到,甲、乙两组的澄清石灰水均变浑浊,集气瓶中发生反应的化学方程式为________。
(2)完全反应后,甲、乙两组的生成物均为黑色粉末,分别用两组的生成物进行以下实验:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 称量黑色粉末质量/g | m1 | m2 |
| 2 | 取黑色粉末,用磁铁吸引 | 全部被吸引 | 全部被吸引 |
| 3 | 取黑色粉末,加入足量CuSO4溶液 | 黑色粉末溶解,有红色物质生成 | 无明显现象 |
(注:铁的氧化物中,只有Fe3O4能被磁铁吸引)
①甲组的黑色粉末与CuSO4溶液反应的化学方程式是_____。
②小明同学查阅资料后发现Fe3O4在常温下不与CuSO4溶液反应,故猜想乙组的生成物为Fe3O4。
小丽提出不同意见:假设乙组黑色粉末中除了有Fe3O4,还可能含有少量铁粉,铁粉的含量低,与硫酸铜溶液反应也可能无明显现象。
为了进一步确定乙组生成物成分,小组同学提出,如果m2恰好为______________g,则小明的猜想正确,如果m2_____________________(填“大于”或“小于”)该质量,则乙组生成物中还含有少量铁粉。
-
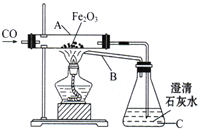
(2010•淮安)钢铁产生是我国的支柱产业之一,选择优质炼铁原料十分重要.甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定.(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应)
(1)甲组同学称取一定质量的赤铁粉,采用如图的装置进行实验.
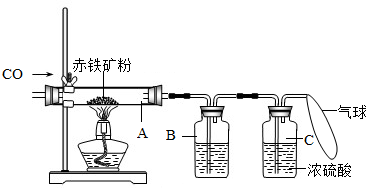
①装置A中发生反应的化学方程式是______ 2Fe+3C02
-
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中杂质性质稳定,既不溶于水也不参与反应,浓硫酸可吸收水蒸气)
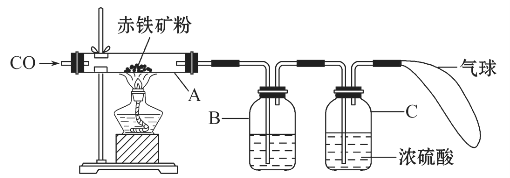
(1)甲组同学称取一定质量的赤铁矿粉,采用如图的装置进行实验。
①装置A中发生反应的化学方程式是 。
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是 浓溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量:
【方法一】称量反应前后A装置的总质量,计算出Fe2O3的含量;
【方法二】称量 得出反应生成的CO2的质量,计算出Fe2O3的含量。
(2)乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应(氧化铁与稀硫酸反应生成硫酸铁和水), (填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价。
-
钢铁产业是我国的支柱产业之一,选择优质炼铁原料十分重要。甲、乙两组同学对某钢铁厂所购进的赤铁矿粉中主要成分Fe2O3的含量进行测定。(假设每步反应均能完全进行,赤铁矿粉中的杂质性质稳定,既不溶于水也不参与反应)
(1)甲组同学称取一定质量的赤铁矿粉,采用如图装置进行实验。
①装置A中发生反应的化学方程式是 。
②为充分吸收反应生成的CO2,装置B中应盛放的试剂是浓 溶液。
③可以通过下面不同的方法计算赤铁矿粉中Fe2O3的含量。
方法一:称量反应前后装置A的总质量,计算出Fe2O3的含量。
方法二:称量 ,得出反应生成的CO2的质量,计算出Fe2O3的含量。
(2)乙组同学称取等质量的赤铁矿粉放入烧杯中,向烧杯中加入过量的稀硫酸充分反应, (填一个操作名称)后立即称量。根据称量的数据计算出Fe2O3的含量。
(3)甲、乙两组同学通过相互比较后对各自的实验方案进行评价。

-
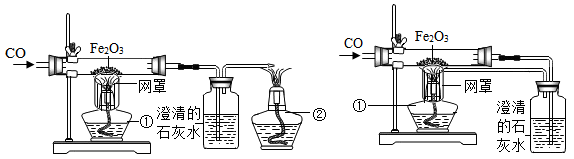
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理。他们设计的实验装置如下图所示。回答下列问题:
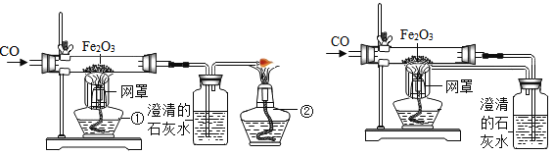
(1)写出用一氧化碳还原氧化铁的化学反应方程式:_____。
(2)实验中澄清石灰水作用是_____。
(3)图甲中第①个酒精灯上网罩的作用是_____。实验时应先点燃第_____个酒精灯。
(4)图乙与图甲相比,它的主要优点是_____。
-
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理。他们设计的实验装置如下图所示。回答下列问题:
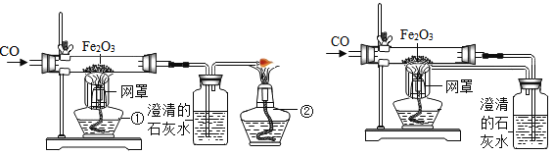
(1)写出用一氧化碳还原氧化铁的化学反应方程式:_____。
(2)实验中澄清石灰水作用是_____。
(3)图甲中第①个酒精灯上网罩的作用是_____。实验时应先点燃第_____个酒精灯。
(4)图乙与图甲相比,它的主要优点是_____。
-
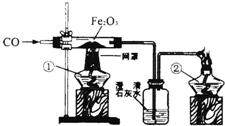
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe2O3)炼铁的主要反应原理.他们设计的实验装置,如图:
回答下列问题:
(1)写出用一氧化碳还原氧化铁的化学方程式______ 2Fe+3CO2
-
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是 Fe2O3)炼铁的主要反应原理,他们设计的实验装置如图所示.
回答下列问题:
(1)写出用一氧化碳还原氧化铁的化学方程式__________________。
(2)实验时,在澄清石灰水中观察到的现象是_____________________。反应的化学方程式是________________________。
(3)图(乙)与左图相比,它的主要优点是_________________________。
-
某课外活动小组的同学们在教师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理.他们设计的实验装置如图所示:
回答下列问题:
(1)写出用一氧化碳还原氧化铁的化学方程式______ 2Fe+3CO2
-
某化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度:
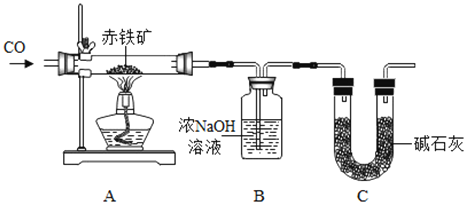
向赤铁矿中通人纯净的一氧化碳气体,假设赤铁矿中杂质不参与反应,请回答下列问题:
(1)实验开始时,先进行的操作是_____________(填序号)。
①通入一氧化碳 ②加热
(2)实验过程中观察到装置A中玻璃管内发生的现象______________。
(3)B装置发生的化学反应方程式是_______________;装置C的作用是________________。
(4)从环境保护的角度看该实验存在的缺陷是_______________。
(5)实验前称量赤铁矿的质量为20g。通入足量的一氧化碳完全反应后B装置总质量增加了13.2g,则赤铁矿中氧化铁的质量分数是多少?写出计算过程____________。

。根据反应装置判断,化学方程式中还缺少的条件是___________________。










