-
某化学兴趣小组通过探究活动学习和理解化学知识.请你一起研究学习,并回答有关问题.
研究主题:水溶液中复分解反应的实质
相关信息:一定体积的溶液中,离子的数目越多,其离子的浓度越大.电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小.相同温度下同种溶液电导率越大,离子浓度越大.
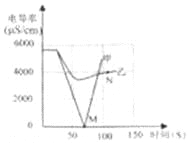
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示.
①写出Ba(OH)2与H2SO4反应的化学方程式 .
②甲曲线M点时混合液体呈 色;
③通过对甲曲线的分析,下列说法错误的是 (填序号).
A.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4[
B.M点时离子浓度几乎为零 C.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
(2)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示.
①通过对乙曲线的分析,下列说法错误的是 (填序号).
A.开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
B.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
C.整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是 (填离子符号).
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度 (填“增大”或“减小”).
(3)拓展:①请根据示例仿写离子方程式.
示例AgNO3+NaCl=AgCl↓+NaNO3离子方程式:Ag++Cl﹣=AgCl↓
仿写:BaCl2+Na2SO4=BaSO4↓+2NaCl离子方程式: .
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊后浑浊逐渐消失.请推测此过程的溶液中Ca2+的浓度变化情况 .
-
某化学兴趣小组通过探究活动学习和理解化学知识.请你一起研究学习,并回答有关问题.
研究主题:水溶液中复分解反应的实质
相关信息:一定体积的溶液中,离子的数目越多,其离子的浓度越大.电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小.相同温度下同种溶液电导率越大,离子浓度越大.
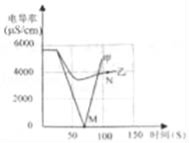
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示.
①写出Ba(OH)2与H2SO4反应的化学方程式 .
②甲曲线M点时混合液体呈 色;
③通过对甲曲线的分析,下列说法错误的是 (填序号).
A.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4
B.M点时离子浓度几乎为零 C.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
(2)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示.
①通过对乙曲线的分析,下列说法错误的是 (填序号).
A.开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
B.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
C.整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是 (填离子符号).
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度 (填“增大”或“减小”).
(3)拓展:①请根据示例仿写离子方程式.
示例AgNO3+NaCl=AgCl↓+NaNO3离子方程式:Ag++Cl﹣=AgCl↓
仿写:BaCl2+Na2SO4=BaSO4↓+2NaCl离子方程式: .
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊后浑浊逐渐消失.请推测此过程的溶液中Ca2+的浓度变化情况 .
-
某化学兴趣小组通过探究活动学习和理解化学知识。请你一起研究学习,并回答有关问题。
研究问题:水溶液中复分解反应的实质
相关信息:(Ⅰ)电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。
(Ⅱ)相同温度下同种溶液电导率越大,离子浓度越大。
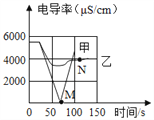
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示。
①写出Ba(OH)2与H2SO4反应的化学方程式________________________。
②M点时电导率为零,离子浓度也几乎为零,此时混合液体静置后呈______色;
③通过对甲曲线的分析,下列说法错误的是_____(填序号)。
A.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4
B.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
(2)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示。
①通过对乙曲线的分析,下列说法正确的是________(填序号)。
A.实际参加反应的是Ba2+和SO42﹣结合成了BaSO4,Na+和OH﹣还是以离子形式存在于溶液中
B.溶液红色只会变浅,但不会褪去
②N点时,溶液中大量含有的离子是__________________(填离子符号,至少写两种)。
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度_______(填“增大”或“减小”)。
(注意:若答对第(3)小题奖励4分,化学试卷总分不超过60分。)
(3)拓展:①请根据示例仿写离子方程式。示例AgNO3+NaCl=AgCl↓+NaNO3离子方程式:Ag++Cl﹣=AgCl↓
仿写:BaCl2+Na2SO4=BaSO4↓+2NaCl离子方程式:________________________________。
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊后浑浊逐渐消失。请推测此过程的溶液中Ca2+的浓度变化情况_____________________。
-
某化学兴趣小组通过探究活动学习化学知识,请你一起参与探究性学习,并回答有关问题。
探究主题:水溶液中发生复分解反应的实质。
相关信息:一定体积的溶液中,离子的数目越多,其浓度越大。电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。相同温度下同种溶液电导率越大,离子浓度越大。
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2~3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示。
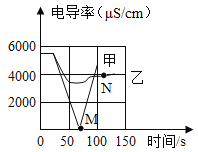
①写出反应的化学方程式:_______________。
②甲曲线M点时混合液体呈____________色。
③通过对甲曲线的分析,下列说法正确的是___________(填字母)。
A、M点前曲线下滑的过程中,H+和OH-结合成H2O,Ba2+和SO42-结合成BaSO4
B、M点时离子浓度几乎为零
C、M点后溶液电导率逐渐增大,仅由于溶液中H+数目在逐渐增大
(3)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2~3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如图乙曲线所示。
①通过对乙曲线的分析,下列说法错误的是___________(填字母)。
A、开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
B、电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
C、整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是_______________(填离子符号)。
③该实验中实际参加反应的离子是____________________。
实验结论:通过分析可知,溶液中发生复分解反应的实质是参与反应的离子结合生成了难电离的____________,导致溶液中的离子浓度_________(填“增大”或“减小”)。
-
某化学兴趣小组学习了酸、碱、盐的知识后,对某些盐的性质开展了探究活动。
研究主题;探究FeCl3溶液加热,灼烧的变化
相关信息:酒精(C2H5OH)具有还原性,加热条件下能与Fe3O4反应;Fe和Fe3O4易被磁铁吸引,FeO是一种黑色固体,不能被磁铁吸引;Fe3O4能与盐酸反应,生成盐和水。
(1)实验一:将大约20mL饱和FeCl3溶液在蒸发皿中加热蒸发,沸腾后发现溶液中逐渐产生红褐色浑浊。
①FeCl3溶液呈黄色主要是因为溶液中含有铁离子,铁离子符号为_______。
②加热时,FeCl3易与水反应生成红褐色物质和盐酸,反应的化学方程式:________。
③由实验启示,FeCl3溶液通过蒸发结晶的方式______(填“能”或“不能”)获得FeCl3固体。
(2)实验二:将实验一蒸发获得的红褐色固体转移到坩埚中灼烧,颜色由红褐色变为红棕色。
①此过程发生分解反应,除生成红棕色物质外,还生成水,反应的化学方程式:_____。
②氢氧化镁、氢氧化铜等加热分解也能得到对应的金属氧化物,结合实验,从物质类别及其溶解性推断,通过加热分解_____________可生成对应的金属氧化物。
(3)实验三:小组同学用多根玻璃棒蘸取饱和FeCl3溶液于酒精灯火焰上灼烧,随着加热时间的持续,在1分钟内观察到玻璃棒表面颜色的变化依次为:黄色、红褐色、红棕色、黑色。
①实验三相对于实验一和二,优点是______(答1点即可)
②同学们对黑色物质的成分产生了疑问。联系酒精的可燃性、还原性等相关性质,对黑色物质的成分提出了猜想,经讨论认为,可能是____________(名称也可)和Fe3O4四种物质中的一种或几种。
③为了确定黑色物质的成分,收集黑色物质,进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取黑色粉末用磁铁吸引,观察现象 | 黑色粉末全部被磁铁吸引 | 综合实验现象判断,此黑色物质成分是____________ |
| 向装有黑色粉末的试管中加入足量的盐酸,充分反应,观察现象 | 固体逐渐溶解,但无气泡产生 |
(4)拓展延伸
①配制FeCl3溶液时,为防止出现红褐色物质,可向其中滴加少量的______________(化学式也可)溶液。
②结合已学知识,从元素化合价变化的角度分析,Fe2O3发生还原反应时,反应前后铁元素化合价一般呈_________(填“上升”或“下降”)的变化。
-
某校化学兴趣小组在学习了催化剂的知识后,想探究氧化铜能否在过氧化氢溶液分解反应中起到催化作用。请你一起参与他们的探究过程,并填写下列空白。
(问题)CuO能不能作过氧化氢溶液分解反应的催化剂呢?
(猜想)____________。
(实验验证)
| 实验 | 实验步骤 | 实验现象 | 实验结论 |
| 实验一 | 在试管中加入少量的H2O2溶液,然后将带火星的木条伸入试管中 | ________ | 常温下H2O2溶液分解速率非常缓慢,放出很少量氧气 |
| 实验二 | 在装有H2O2溶液的试管中加入少量的CuO,然后将带火星的木条伸入试管中 | 有较多气泡产生,木条复燃 | ____________ |
(讨论与反思)经过讨论,有的同学认为只有上述两个实验,不能证明CuO能作过氧化氢溶液分解反应的催化剂,还要补充一个探究实验。
实验三:
(实验目的)探究_____________。
(实验步骤)①准确称量CuO(少量)的质量;
②重复实验二的步骤;待反应结束,将试管里的物质过滤,洗涤,干燥,称量;
③对比反应前后CuO的质量。
(讨论)如果_______________,则说明CuO能作过氧化氢溶液分解反应的催化剂。
但小华认为,要证明猜想,上述三个实验还不足以说明,还需要再增加一个实验。
(实验目的)________________。
(实验结论)CuO能作过氧化氢溶液分解反应的催化剂,请写出CuO催化过氧化氢分解的文字表达式:
_______________。
(拓展探究)同种催化剂,还有哪些因素会影响过氧化氢分解反应的催化效果?
假设:________________。
-
某校化学兴趣小组在学习了催化剂的知识后,想探究氧化铜能否在过氧化氢溶液分解反应中起到催化作用。请你一起参与他们的探究过程,并填写下列空白。
(问题)CuO能不能作过氧化氢溶液分解反应的催化剂呢?
(猜想)____________。
(实验验证)
| 实验 | 实验步骤 | 实验现象 | 实验结论 |
| 实验一 | 在试管中加入少量的H2O2溶液,然后将带火星的木条伸入试管中 | ________ | 常温下H2O2溶液分解速率非常缓慢,放出很少量氧气 |
| 实验二 | 在装有H2O2溶液的试管中加入少量的CuO,然后将带火星的木条伸入试管中 | 有较多气泡产生,木条复燃 | ____________ |
(讨论与反思)经过讨论,有的同学认为只有上述两个实验,不能证明CuO能作过氧化氢溶液分解反应的催化剂,还要补充一个探究实验。
实验三:
(实验目的)探究_____________。
(实验步骤)①准确称量CuO(少量)的质量;
②重复实验二的步骤;待反应结束,将试管里的物质过滤,洗涤,干燥,称量;
③对比反应前后CuO的质量。
(讨论)如果_______________,则说明CuO能作过氧化氢溶液分解反应的催化剂。
但小华认为,要证明猜想,上述三个实验还不足以说明,还需要再增加一个实验。
(实验目的)________________。
(实验结论)CuO能作过氧化氢溶液分解反应的催化剂,请写出CuO催化过氧化氢分解的文字表达式:
_______________。
(拓展探究)同种催化剂,还有哪些因素会影响过氧化氢分解反应的催化效果?
假设:________________。
-
某校化学兴趣小组在学习了催化剂的知识后,想探究氧化铜能否在过氧化氢溶液分解反应中起到催化作用。请你一起参与他们的探究过程,并完成下列填空。
(提出问题)CuO能不能作过氧化氢溶液分解反应的催化剂呢?
(做出猜想)CuO能作过氧化氢溶液分解反应的催化剂。
(实验验证)
| 实验 | 实验步骤 | 实验现象 | 实验结论 |
| 实验一 | 在试管中加入少量的H2O2溶液,然后将带火星的木条伸入试管中 | __________ | 常温下H2O2溶液分解速率非常缓慢,放出极少量的氧气 |
| 实验二 | 在装有等量H2O2溶液的试管中加入少量的CuO,然后将带火星的木条伸入试管中 | 有较多气泡产生,木条复燃 | ___________ |
(讨论与反思)经过讨论,有的同学认为只有上述两个实验,不能证明CuO能作过氧化氢溶液分解反应的催化剂,还要补充一个探究实验。
实验三:
(实验目的)探究在反应前后CuO的质量是否发生改变。
(实验步骤)①准确称量CuO(少量)的质量;
②重复实验二的步骤,待反应结束后,将试管里的物质过滤,洗涤,干燥,称重;
③对比反应前后CuO的质量。
(讨论交流)如果_________,则说明CuO能作过氧化氢溶液分解反应的催化剂。但小华认为,要证明猜想,上述三个实验还不足以说明,还需要再增加一个实验。
(实验目的)_________
(实验结论)CuO能作过氧化氢溶液分解反应的催化剂,请写出CuO催化过氧化氢溶液分解的文字表达式:____________。
-
某校化学兴趣小组同学在学习了催化剂的知识后,想探究氧化铁能否在过氧化氢溶液分解反应中起到催化作用.请你一起参与他们的探究过程,并填写下列空白.
[问题]Fe2O3能不能做过氧化氢溶液分解反应的催化剂呢?
[猜想]______.
[实验验证]
| | 实验步骤 | 实验现象 | 实验结论 |
| 实验一 | 在试管中加入少量的H2O2溶液,然后将带火星的木条伸入试管中 | 木条不复燃 | 常温下H2O2溶液分解速率非常缓慢,放出很少量氧气,因此木条不能复燃. |
| 实验二 | 在装有H2O2溶液的试管中加入少量的Fe2O3,然后将带火星的木条伸入试管中 | 木条复燃 | |
[结论]______
[讨论与反思]经过讨论,有的同学认为只有上述两个实验,不能证明Fe2O3能作过氧化氢溶液分解反应的催化剂,还要补充一个探究实验.
实验三:[实验目的]探究______.
[实验步骤]①准确称量Fe2O3(少量)的质量;②重复实验二的步骤;③待反应结束,将试管里的物质进行______,洗涤,干燥,称量;④对比反应前后Fe2O3的质量.
[讨论]如果______,则说明Fe2O3能作过氧化氢溶液分解反应的催化剂.
但小华认为,要证明猜想,上述三个实验还不足以说明问题,还需要再增加一个探究实验.
实验四:[实验目的]探究______.
若小华用如下装置和相应的操作进行实验,请你回答下列问题.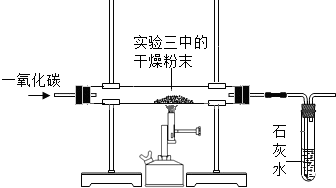
(1)一氧化碳还原干燥粉末前,为安全起见,应进行的一项重要操作是______.
(2)能够证明猜想的实验现象是______
(3)上述实验的尾气不能直接排放到空气中,请你说出一种处理尾气的方法:______.
-
某校化学兴趣小组同学在学习了催化剂的知识后,想探究氧化铁能否在过氧化氢溶液分解反应中起到催化作用.请你一起参与他们的探究过程,并填写下列空白.
[问题]Fe2O3能不能做过氧化氢溶液分解反应的催化剂呢?
[猜想]Fe2O3能做过氧化氢溶液分解反应的催化剂.
[实验验证]
| 实验步骤 | 实验现象 | 实验结论 |
| 实验一 | 在试管中加入少量的H2O2溶液,然后将带火星的木条伸入试管中 | 木条不复燃 | 常温下H2O2溶液分解速率非常缓慢,放出很少量氧气,因此木条不能复燃. |
| 实验二 | 在装有H2O2溶液的试管中加入少量的Fe2O3,然后将带火星的木条伸入试管中 | 木条复燃 | ________ |
[结论]Fe2O3能加快过氧化氢溶液的分解速率,故Fe2O3能作过氧化氢溶液分解反应的催化剂.
[讨论与反思]经过讨论,有的同学认为只有上述两个实验,不能证明Fe2O3能作过氧化氢溶液分解反应的催化剂,还要补充一个探究实验.
实验三:
[实验目的]探究________.
[实验步骤]
①准确称量Fe2O3(少量)的质量;
②重复实验二的步骤;
③待反应结束,将试管里的物质进行________,洗涤,干燥,称量;
④对比反应前后Fe2O3的质量.
[讨论]
如果Fe2O3在反应前后质量不变,则说明Fe2O3能作过氧化氢溶液分解反应的催化剂.
但小华认为,要证明猜想,上述三个实验还不足以说明问题,还需要再增加一个探究实验.
实验四:
[实验目的]探究________.
小华用如下装置和相应的操作进行实验.
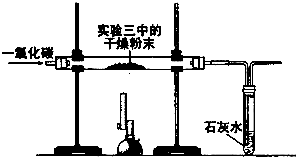
(1)一氧化碳还原干燥粉末前,为安全起见,应进行的一项重要操作是________.
(2)能够证明猜想的实验现象是________;
(3)上述实验的尾气不能直接排放到空气中,请你说出一种处理尾气的方法________.





