-
(13分)精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:
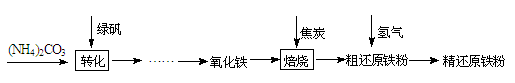
粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为: 、
、 。
。
(1)写出焙烧中氧化铁与CO反应的化学方程式 。
(2)焙烧中加焦炭的作用除了可以作燃料提供反应所需高温外,还能 。
【含量测定】甲同学为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。已知:3CH4+4Fe2O3  3CO2+6H2O+8Fe ,浓硫酸有吸水性,碱石灰不仅能吸收水而且能吸收CO2。(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响)。
3CO2+6H2O+8Fe ,浓硫酸有吸水性,碱石灰不仅能吸收水而且能吸收CO2。(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响)。
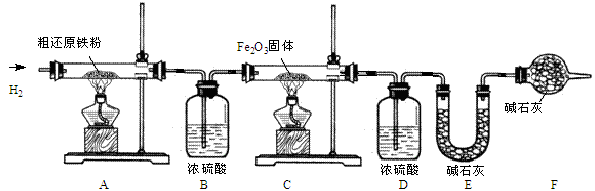
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②缓缓通入纯净干燥的H2;
③点燃C处酒精灯;
④点燃A 处酒精灯;
⑤分别熄灭A、C处酒精灯;
⑥ ;
⑦再次称量必要装置的质量。
(4)步骤②的目的是 ,验证该步骤目的达到的实验方法是 。
(5)反应后C装置中的现象是 。
(6)装置F的作用是 。
(7)若缺少装置D,则所测氧元素的质量分数将 (“偏大”、“偏小”或“不变”)。
(8)实验后,甲同学根据装置 (填A、B、C、D、E、F)的增重分别算得样品中氧和碳元素的质量分数。
(9)乙同学将10.0克粗还原铁粉样品与足量稀盐酸充分反应,经测定共产生0.3克气体。计算该粗还原铁粉样品中铁单质的质量分数。(要求写出计算过程)
-
探究二:精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:
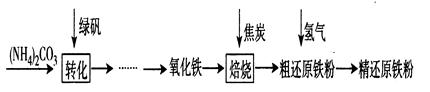
粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy + y H2 x Fe + y H2O,Fe3C + 2 H2
x Fe + y H2O,Fe3C + 2 H2 3 Fe + CH4。
3 Fe + CH4。
(1)写出焙烧中氧化铁与CO反应的化学方程式:________。
(2)焙烧中加焦炭的作用除了可以生成CO外,还能________。
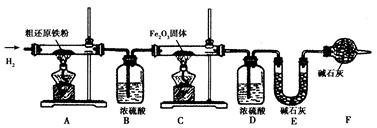
【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。已知3 CH4 + 4 Fe2O3 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灭A处、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量。
操作的先后顺序是①→③→________→⑤→⑥→⑦(填字母)
A.②→④ B.④→②
(4)步骤③的目的是________,验证该步骤目的达到的实验方法是________;
(5)若缺少装置D,则所测氧元素的质量分数将________(填“偏大’’“偏小"或“不变")。
(6)粗还原铁粉样品的质量为20.000 g,装置B、E分别增重0.360 g和0.440 g,则计算样品出中碳元素的质量分数是________,氧元素的质量分数是________。
-
精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
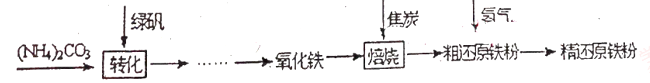
(物质制备)利用绿矾制备精还原铁粉的工艺流程如下:
粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为:
Fe3C+2H2 3Fe+CH4 FexOy+yH2
3Fe+CH4 FexOy+yH2 xFe+yH2O
xFe+yH2O
(1)已知焙烧中发生的主要反应是CO夺取氧化铁中的氧元素,得到单质铁与另一种碳的氧化物,请写出该反应的化学方程式_____________。
(2)焙烧中加焦炭的作用除了可以作燃料提供反应所需高温外,还能________。
(含量测定)甲同学为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。已知:3CH4+4Fe2O3 3CO2+6H2O+8Fe,浓硫酸有吸水性,可以吸收混合气体中的水热气,碱石灰不仅 能吸收水而且能吸收CO2。(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响)。
3CO2+6H2O+8Fe,浓硫酸有吸水性,可以吸收混合气体中的水热气,碱石灰不仅 能吸收水而且能吸收CO2。(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响)。
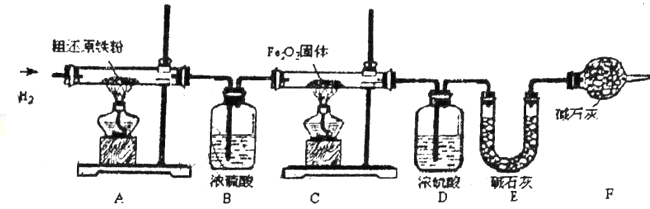
(3)主要实验步驟如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②缓缓通入纯净干燥的H2;③点燃C处酒精灯;④点燃A处酒精灯;⑤分别熄灭A、C处酒精灯;⑥再次缓缓通入H2;⑦再次称量必要装置的质量。
步骤②的目的是___________,步骤⑥的目的是__________。
(4)反应后C装置中的现象是_____________。
(5)若缺少装置F,则所测碳元素的质量分数将_____________(“偏大”、“偏小”或“不变”)。
-
粗还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
[物质制备]利用绿矾制备精还原铁粉的工艺流程如下:
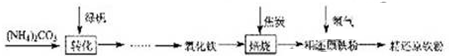
粗还原铁粉中还含有少量铁的氧化物和Fe3C,可用氢气在高温下进一步还原,其反应方程式为:FexOY+yH2 xFe+yH2O Fe3C+2H2
xFe+yH2O Fe3C+2H2 3Fe+CH4
3Fe+CH4
(1)写出焙烧中氧化铁与CO反应的化学方程式________.
(2)焙烧中加焦炭的作用除了可以生成CO外,还能________.
[含量测定]为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行试验,已知 3CH4+4Fe2O3 3CO2+6H2O+8Fe
3CO2+6H2O+8Fe
(假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).
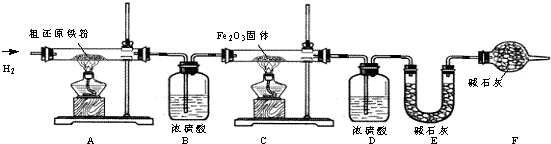
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灯A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量.
操作的先后顺序是①③________⑤⑥⑦(填序号);
(4)步骤③的目的是________,验证该步骤目的达到的实验方法是________;步骤⑥的目的是________
(5)若装置D、E分别增重mg和ng,则m与n的关系为________
A.11m=9n B.11m<9n C.11m>9n
若缺少装置D,则所测氧元素的质量分数将________(填“偏大”、“偏小”或“等于”.下同).碳元素的质量分数将________.
(6)粗还原铁粉样品的质量为10.000g,装置B,E分别增重0.180g和0.220g.计算样品中氧和碳元素的质量分数(要求计算过程).
-
粗还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
[物质制备]利用绿矾制备精还原铁粉的工艺流程如下:
粗还原铁粉中还含有少量铁的氧化物和Fe3C,可用氢气在高温下进一步还原,其反应方程式为:FexOY+yH2 xFe+yH2O Fe3C+2H2
xFe+yH2O Fe3C+2H2 3Fe+CH4
3Fe+CH4
(1)写出焙烧中氧化铁与CO反应的化学方程式________.
(2)焙烧中加焦炭的作用除了可以生成CO外,还能________.
[含量测定]为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行试验,已知 3CH4+4Fe2O3 3CO2+6H2O+8Fe
3CO2+6H2O+8Fe
(假设每步反应都完全且不考虑装置内原来有空气对测定结果的影响).
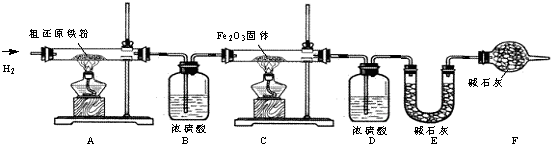
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灯A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次称量必要装置的质量.
操作的先后顺序是①③________⑤⑥⑦(填序号);
(4)步骤③的目的是________,验证该步骤目的达到的实验方法是________;步骤⑥的目的是________
(5)若装置D、E分别增重mg和ng,则m与n的关系为________
A.11m=9n B.11m<9n C.11m>9n
若缺少装置D,则所测氧元素的质量分数将________(填“偏大”、“偏小”或“等于”.下同).碳元素的质量分数将________.
(6)粗还原铁粉样品的质量为10.000g,装置B,E分别增重0.180g和0.220g.计算样品中氧和碳元素的质量分数(要求计算过程).
-
绿矾(FeSO4•7H2O)是重要工业产品,可用于制备Fe2O3,复印用Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作。某研究性小组展开了系列研究。
Ⅰ.制备Fe2O3
(资料一)
(1)无水硫酸铜遇水变成蓝色的硫酸铜晶体。
(2)绿矾(FeSO4•7H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物。
(3)SO2是无色有刺激性的有毒气体,能使品红溶液褪色;SO3在0℃是一种无色晶体。
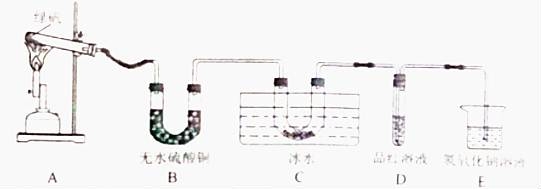
甲同学用如图1装置制备Fe2O3并验证绿矾受热分解的其他产物:
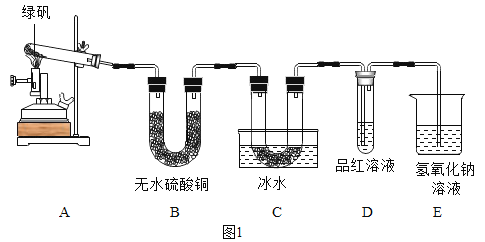
实验过程中发现:A中有红棕色固体生成,B中无水硫酸铜变蓝,C中U形管内有无色晶体析出,D中品红溶液褪色。以上能证明有水生成的现象是______,装置E的作用是______,绿矾高温分解的化学方程式为______。
Ⅱ.制备Fe3O4
乙同学模拟生产复印用Fe3O4粉的实验流程如图2:
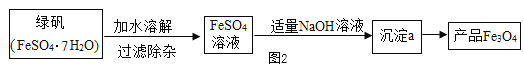
(资料二)Fe(OH)2是一种白色难溶于水的固体,在空气中易被氧气所氧化,制备时必须尽量排除氧气的干扰。
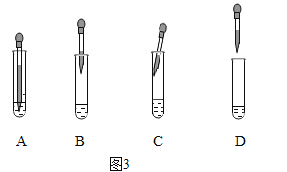
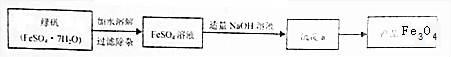
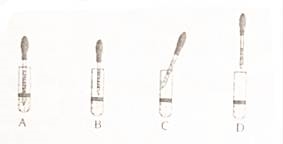
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为:①______,②4Fe(OH)2+O2+2H2O=4Fe(OH)3.由沉淀a获得Fe3O4的化学方程式为:Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O,若制取Fe(OH)2,采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶滴管加煮沸的NaOH溶液(已经排尽O2),图3中该实验使用胶头滴管的滴加NaOH溶液使用方法正确的是______(填字母)。
Ⅲ.制备还原铁粉
制备还原铁粉的工业流程如图4:
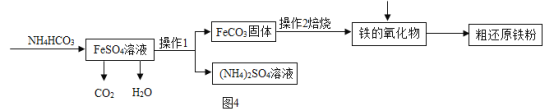
(1)操作1的名称是______。
(2)粗还原铁粉经加工处理后变成纯还原铁粉,纯还原铁粉和水蒸气在高温条件下也可制得四氧化三铁,同时生成一种气体。其装置如图5所示:
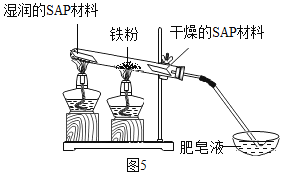
SAP材料用途较多,其吸水性强,湿润的SAP材料能为该反应持续提供水蒸气。实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中。生成的气体是______,干燥的SAP材料作用是______,请写出该反应的化学方程式______。
-
绿矾(FeSO4•7H2O)是硫酸法生产太白粉的主要副产物,可用于制备Fe2O3,复印用Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作。某研究性小组展开了系列研究。
Ⅰ.制备Fe2O3
【资料一】
(1)无水硫酸铜遇水变成蓝色的硫酸铜晶体。
(2)绿矾(FeSO4•7H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物。
(3)SO2是无色有窒息性臭味的有毒气体,能使品红溶液褪色。
甲同学用如下装置制备Fe2O3并验证绿矾受热分解的其他产物:
实验过程中发现:A中有 色固体生成,B中无水硫酸铜变蓝,C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是 ,绿矾高温分解的化学方程式为 。
Ⅱ.制备Fe3O4
乙同学模拟生产复印用Fe3O4粉的实验流程如下:
【资料二】Fe(OH)2是一种白色难溶于水的固体,在空气中易被氧化。
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为:
① ,②4Fe(OH)2+O2+2H2O═4Fe(OH)2。
由沉淀a获得Fe3O4的化学方程式为:Fe(OH)2+Fe(OH)2═Fe3O4+4H2O
若制取Fe(OH)2,采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶头滴管加煮沸的NaOH溶液(驱赶O2),胶头滴管的争取使用方法是 (填字母)。
Ⅲ.制备还原铁粉
制备还原铁粉的工业流程如下:
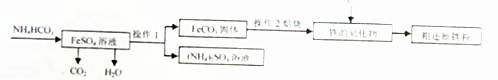
(1)操作1的名称是 ,NH4HCO3和FeSO4溶液反应的化学方程式为 。
(2)若将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量FexC)在氧气流中完全反应,得到0.22g
CO2,将相同质量的粗还原铁粉与足量稀硫酸反应,得到0.48gH2(FexC与稀硫酸反应不产生H2)。试通过计算确定FexC的化学式(请写出计算过程) 。
(3)粗还原铁粉经加工处理后变成纯还原铁粉,纯还原铁粉和水蒸气在高温条件下也可制得四氧化三铁,同时生成一种气体。其装置如图所示:
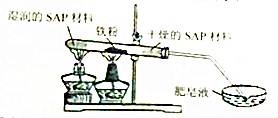
SAP材料吸水性强,湿润的SAP材料能为该反应持续提供水蒸气。实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中。生成的气体 是 ,干燥的SAP材料作用是 。
-
还原铁粉是结构疏松的单质铁,是重要的工业原料。
I.物质制备。还原铁粉的某种制备工艺流程如下:
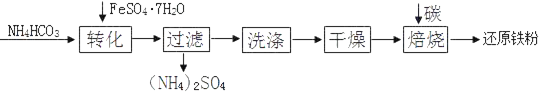
(1)“转化”时温度需控制在35℃以下,防止受热分解的物质是_____。
(2)“干燥”过程中有少量的FeCO3转化为FeOOH和CO2,此时与FeCO3反应的物质有_____(填化学式)
(3)FeCO3和 FeOOH在空气中焙烧转化为Fe2O3,FeOOH转化为Fe2O3的反应类型是_____。写出Fe2O3在高温条件下与碳(C)反应生成Fe和CO2的化学方程式:_____。
Ⅱ.成分研究。“暖宝宝”一般由还原铁粉、活性炭和氯化钠等组成。
(实验目的)测定未开启的“暖宝宝”中铁的质量分数。
(实验过程)如图五所示,甲同学称得反应前总质量为85g,打开活塞待稀盐酸全部滴入后立即关闭活塞。锥形瓶内的现象有:固体逐渐减少,_____。反应完毕后测得锥形瓶和反应后混合物的总质量为84.8g。

(评价反思)
(1)乙同学认为甲同学方案误差较大,于是设计如图六的方案。甲同学方案误差较大的原因是_____。
(2)丙同学认为乙同学方案即使操作无失误,测量结果仍会偏大,原因是_____。
(3)丙同学设计了图七的实验装置。利用该装置实验时,在气密性良好的前提下,如果往锥形瓶中注入的稀盐酸体积为V1mL,等充分反应并且待装置冷却后,观察右侧注射器读数増加V2mL.实验条件下氢气密度为 d g/mL.则样品中铁的质量分数为_____。
-
还原铁粉是化工生产及实验室中常用的还原剂。工业上以绿矾(FeSO4·7H2O)为原料制备还原铁粉的工艺流程见图1。
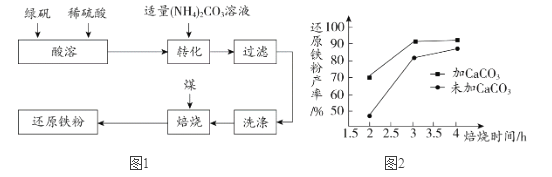
(1)转化时,将(NH4)2CO3溶液加入到FeSO4溶液中,目的是制得FeCO3。
(2)将FeCO3浊液暴露在空气中,反应的化学方程式为: ,其中X是_____。
,其中X是_____。
(3)焙烧时,发生的反应有:① ; ②
; ② ;③
;③ ,其中属于分解反应的是________(填序号)。
,其中属于分解反应的是________(填序号)。
(4) 在焙烧过程中需加入CaCO3进行脱硫处理。图2为加CaCO3和不加CaCO3对还原铁粉产率的影响,由图可以得出的结论是_____________。
-
绿矾的一种综合利用其工艺流程如下(主要是生产还原铁粉):
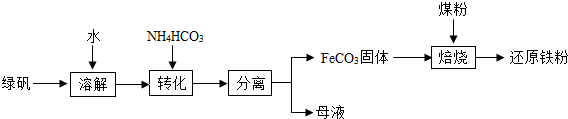
(1)工艺流程中“分离”常用的操作是________.
(2)绿矾溶解成浅绿色溶液,溶液中存在的阳离子是________.
(3)隔绝空气进行“焙烧”,FeCO3会分解生成氧化亚铁和二氧化碳,焙烧过程中作为还原剂的是一氧化碳.
①产生还原剂一氧化碳的反应化学方程式是________.
②产生铁粉的反应化学方程式是________.
(4)116g FeCO3含有铁元素的质量是________g.























