-
实验课上,为检验镁条能否在N2中燃烧,某兴趣小组开展如下探究:
(查阅资料)氮化镁(Mg3N2)是一种淡黄色固体,能和水反应,生成Mg(OH)2和NH3;
(实验步骤)
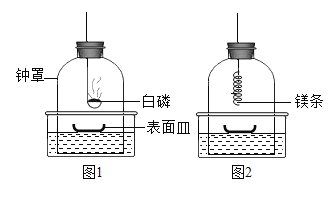
①将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞(图1);
②待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
③打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2);
④待钟罩内水面不再变化时,观察钟罩内壁及表面皿中固体颜色,取少量固体加入水中。
(1)(分析)
a.步骤①中足量白磷在钟罩内燃烧的目的是________;
b.步骤③中镁条剧烈燃烧,反应的化学方程式为________;
c.步骤④中钟罩内壁及表面皿中出现淡黄色固体,加入水中,产生白色浑浊及能使湿润红色石蕊试纸变蓝色的气体,反应的化学方程式为________;
(2)(结论)镁能在N2中燃烧,并生成Mg3N2。
请你判断:2.40g镁条在某充满空气的密闭容器中完全燃烧,所得固体质量可能为________。
a.3.33g b.3.93g c.4.00g d.3.96g
-
实验课上,为检验镁条能否在N2中燃烧,某兴趣小组开展如下探究:
【查阅资料】氮化镁(Mg3N2)是一种淡黄色固体,能和水反应,生成Mg(OH)2和NH3;
【实验步骤】
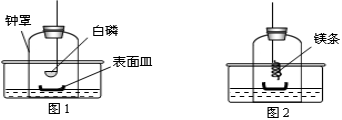
①将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞(图1);
②待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
③打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2);
④待钟罩内水面不再变化时,观察钟罩内壁及表面皿中固体颜色,取少量固体加入水中。
【分析】
(1)步骤①中足量白磷在钟罩内燃烧的目的是 ;
(2)步骤③中镁条剧烈燃烧,反应的化学方程式为 ;
(3)步骤④中钟罩内壁及表面皿中出现淡黄色固体,加入水中,产生白色浑浊及能使湿润红色石蕊试纸变蓝色的气体,反应的化学方程式为 ;
【结论】镁能在N2中燃烧,并生成Mg3N2。
(4)请你判断:2.40g镁条在某充满空气的密闭容器中完全燃烧,所得固体质量可能为 。
A.3.33g B.3.93g C.4.00g D.3.96g
-
实验课上,为检验镁条能否在N2中燃烧,某兴趣小组开展如下探究:

【查阅资料】
(1)氮化镁(Mg3N2)是一种淡黄色固体,能和水反应,生成Mg(OH)2和NH3;
(2)NH3能是湿润红色石蕊试纸变蓝色
【实验步骤】
①将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞(图1);
②待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
③打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2);
④待钟罩内水面不再变化时,观察钟罩内壁及表面皿中固体颜色,取少量固体加入水中.
【分析】
(1)步骤①中足量白磷在钟罩内燃烧的目的是 ;
(2)步骤③中镁条剧烈燃烧,反应的化学方程式为 ;
(3)步骤④中钟罩内壁及表面皿中出现淡黄色固体,加入水中,产生白色浑浊及能使湿润红色石蕊试纸变蓝色的气体,反应的化学方程式为 ;
【结论】镁能在N2中燃烧,并生成Mg3N2.
-
实验课上,为检验镁条能否在N2中燃烧,兴趣小组展开如下探究:
[查阅资料]氮化镁(Mg3N2)是一种淡黄色固体,能和水反应,生成Mg(OH)2和NH3;
[实验步骤]
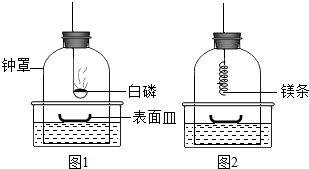
①将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞(图1);
②待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
③打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2);
④待钟罩内水面不再变化时,观察钟罩内壁及表面皿中固体颜色,取少量固体加入水中.
[分析]
(1)步骤①中足量白磷在钟罩内燃烧的目的是________;
(2)步骤②中加水的目的是________;
(3)步骤③中镁条绕城螺旋状的目的是________;镁条剧烈燃烧,反应的化学方程式为________;
(4)步骤④中钟罩内壁及表面皿中出现淡黄色固体.加入水中,产生白色浑浊及能使湿润红色石蕊试纸变________色的气体,反应的化学方程式为________;
[结论]
镁能在N2中燃烧,并生成Mg3N2.
(5)请你判断:2.40g镁条在某密闭容器中完全燃烧,所得固体质量可能为________;
[相对分子质量--Mr(MgO):40、Mr(Mg3N2):100]
A.3.33g B.4.00g C.3.93g D.3.96g.
-
某科学兴趣小组查阅资料得知镁可在氮气中燃烧生成氮化镁(Mg3N2),设计了如下方案进行验证。

步骤l:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置;另准备一只有一根铜丝穿过的橡皮塞,
铜丝末端固定一根镁条。
步骤2:引燃燃烧匙中足量的红磷,塞好橡皮塞;待充分冷却,
观察到广口瓶内水面上升的体积约占瓶内水面原上方空间的1/5左右。
步骤3:往水槽中加水使广口瓶内外水面相平;点燃镁条,更换橡皮塞,镁条在广口瓶内继续燃烧,放出热量;待冷却后广口瓶内水位继续上升。
(1)步骤2的目的是________。写出红磷在氧气中燃烧的化学方程式________;
(2)在步骤3“待冷却后广口瓶内水位继续上升”是由于瓶内气压 (选填“大于”“小于”或“等于”)外界气压。
(3)根据上述实验和你所学的知识,请写出镁在空气中燃烧时的化学方程式:①镁与氧气反应:________;②①镁与氮气反应:________。
-
小红按下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。

(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(作出猜想)黄色固体是Mg3N2。
(实验探究)设计实验,验证猜想:
| 实验操作 | 实验现象及结论 |
| __________ | ___________ |
(反思与交流)①空气中N2的含量远大于O2的含量,可是镁条在空气中的燃烧产物MgO却远多于Mg3N2,合理的解释是________。
②同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识________。
-
某科学兴趣小组查阅资料得知镁可在氮气中燃烧生成固体氮化镁(其中氮元素的化合价为- 3价) , 设计了如下方案进行验证。
步骤1.用盛水的水槽、无底的广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置。另准备一只有一根铜丝穿过的橡皮塞,铜丝末端固定一根镁条。
步骤2.点燃燃烧匙中足量的红磷,迅速塞好橡皮塞。待充分冷却,观察到广口瓶内水面上升的体积约占瓶内原空气总体积的 左右。
左右。
步骤3.往水槽中加水使广口瓶内外水面相平。点燃镁条,迅速更换橡皮塞,观察到镁条在广口瓶内仍继续燃烧。待冷却后广口瓶内水位继续上升。

(1)步骤2的目的是____________________________;同时也验证了氧气约占空气体积约 。写出步骤2中红磷反应的化学方程式____________________________;
。写出步骤2中红磷反应的化学方程式____________________________;
(2)在步骤3“待冷却后广口瓶内水位继续上升”是由于瓶内气压____________________________(选填 “大于”“小于”或“等于”)外界气压。
(3)请写出镁在氮气中燃烧的化学方程式 ____________________________;镁在氧气中和在氮气中的燃烧,均属于基本反应类型中的____________________________反应。
-
镁条在空气中久置表面会变黑,对镁条变黑条件及黑色物质成分作如下探究。
(查阅)①氮化镁(Mg3N2)是黄色固体。②Na2SO3可与O2发生化合反应生成硫酸钠。③NaOH溶液能吸收CO2气体
(猜测)镁条变黑可能原因:①空气中O2使镁条变黑;②空气中的N2使镁条变黑;③…,猜想①、②均不合理,理由分别是_____、_____。
(实验)用图示装置(镁条长度及试管容积均相同),分别进行下列实验。20天后,前3支试管中镁条始终无明显变化,仅试管D中线条表面全部变黑。
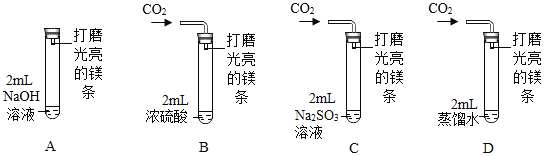
(结论)
(1)试管C中,Na2SO3溶液的作用是_____(用化学方程式表示)。
(2)得出“镁条变黑一定与CO2有关”结论,依据的实验是_____(试管编号)与D对照。
(3)由上述实验推知,镁条变黑与_____(填序号)有关。
a、CO2和H2O b、H2O和O2 c、CO2和O2 d、CO2、H2O和O2
(查阅)①镁表面黑色物质是Mgx(OH)yCO3(以下用M表示)
②Mgx(OH)yCO3受热会分解为MgO、 H2O和CO2。
(4)取14.2g M充分加热,完全反应后得剩余固体8.0g、CO24.4 g,则M中x:y=_____。
-
某校化学兴趣小组同学做镁带在空气中燃烧的实验时,发现白色生成物中混有少量淡黄色固体.针对这一现象,他们开展了如下实验探究.请仔细阅读并完成下列探究报告.
探究目的:探究镁在空气中燃烧产生的淡黄色固体是镁与空气中什么物质反应产生的?
分析猜想:分析空气中各种成分,寻找猜想依据.
干燥空气中各组分气体的体积分数大约是:氮气________%,氧气________%,稀有气体0.94%,二氧化碳0.03%,其他气体和杂质0.03%
已学知识:氧气与镁反应生成的氧化镁是白色固体.
查阅资料:稀有气体化学性质稳定,一般不与其它物质反应.
猜想1:可能是镁与氮气反应生成淡黄色固体.
猜想2:可能是镁与二氧化碳反应生成淡黄色固体.
猜想3:可能是镁与________生成淡黄色固体.
实验一:镁带与氮气的反应
(一)获取氮气
(1)把空气除尘净化,除去二氧化碳和水蒸气,液化后再蒸发,先蒸发出来的气体就是氮气.这种方法属于________(选填“物理”或“化学”)方法.但在实验室里空气不易被液化.
(2)如图是获取氮气的方法及装置.用燃烧法除去空气(已除去二氧化碳、水蒸气和杂质)中的氧气从而得到较纯净的氮气,燃烧匙内选用的物质最好是________.
A.木炭 B.蜡烛C.红磷 D.铁丝
(二)燃烧镁带,观察现象
将镁带打磨光亮,点燃,伸入盛氮气的集气瓶中,瓶内壁附着一层淡黄色的固体.
(三)实验结论:镁与氮气在点燃的条件下发生化合反应生成淡黄色的氮化镁(Mg3N2).
该反应的化学方程式是________.
实验二:将燃着的镁带伸入盛二氧化碳的集气瓶中,镁带剧烈燃烧,瓶内出现白色固体和黑色固体.生成的黑色固体物质的化学式是________.
实验结论:镁在空气中燃烧产生的淡黄色固体是镁与空气中的________反应产生的.
反思与评价:通过上述的实验及所学知识,你对燃烧的条件有什么新的认识?________.
拓展与迁移:________(填“能”或“不能”)用镁条代替红磷完成测定空气中氧气含量的实验,理由是________.

-
超氧化钾(KO2)是一种黄色固体,可用作呼吸面具的供氧剂。实验室有一瓶放置较长时间的超氧化钾样品,某化学兴趣小组对其成分和性质进行了如下探究。
(查阅资料)Ⅰ超氧化钾能与空气中水或二氧化碳反应生成氧气并放热:
4KO2+2CO2==2K2CO3+3O2,4KO2+2H2O==4KOH+3O2↑。
(提出问题)超氧化钾是否变质?
(猜想与假设)假设1:超氧化钾未变质;假设2:_____;假设3:超氧化钾全部变质。
(实验探究)
| 序号 | 实验步骤 | 实验现象 | 实验结论 |
| ① | 取部分固体于试管中,加入足量的水,在试管口插入带火星的木条。 | 固体完全溶解,放热,木条复燃 | 假设_____不成立 |
| ② | 取少量①中溶液于试管中,滴加足量的_____, 振荡。 | 有气泡生成 | 假设2成立 |
(提出新问题)部分变质的超氧化钾样品中是否含有氢氧化钾呢?
(实验探究)③取少量①中溶液于试管中,加入足量的氯化钙溶液,有白色沉淀生成,静置,向上层清液中滴加2滴无色酚酞试液,溶液变红。
(定性分析)(l)由实验探究③可以确定①中溶液含有的溶质是_____(填化学式);
(2)小明认为,由上述实验无法确定原固体样品中是否含有氢氧化钾,理由是_____。
(反思提高)超氧化钾长时间露置在空气中会全部变质,最终转化为_____(填化学式)。








