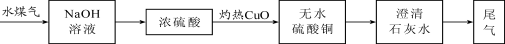-
水煤气是一种工业上常用的气体燃料,一般用焦炭和水蒸气在高温下反应制得,含有少量的CO2和水蒸气杂质.某化学兴趣小组对水煤气的主要成分进行研究.
【查阅资料】
(1)白色的无水硫酸铜粉末遇水变成蓝色;
(2)Na2CO3与少量盐酸反应生成NaHCO3和NaCl,与过量盐酸反应时生成NaCl,H2O,CO2
【实验假设】
①可燃气只是CO
②可燃气体只是H2
③可燃气体是CO,H2的混合气.
【实验过程】
实验小组按以下流程进行实验(水煤气中CO2,H2O已被充分吸收);

实验中,发现黑色氧化铜变红,且______,证明水煤气含有H2;还观察到澄清石灰水变浑浊,证明水煤气含有另一可燃气体为______
【实验反思】
根据实验结论,甲同学认为实验应保证安全,防止中毒,对尾气的处理方法是______
【实验拓展】
(1)实验后,乙同学认为欲检验所用NaOH是否完全消耗,可向溶液中滴入几滴稀盐酸,若没有气体产生,则溶液中还有NaOH剩余,但丙同学认为乙同学的设计是错误的,理由是______
(2)丁同学通过本次实验,结合查阅的资料发现,不用任何其它试剂,只用试管和胶头滴管就可以鉴别稀盐酸和碳酸钠两种无色溶液.正确的鉴别方案及结论是______.
-
水煤气是一种工业上常用的气体燃料,一般用焦炭和水蒸气在高温下反应制得,含有少量的CO2和水蒸气杂质。某化学兴趣小组对水煤气的主要成分进行探究。
【查阅资料】
(1)白色的无水硫酸铜粉末遇水变成蓝色;
(2)Na2CO3与少量盐酸反应生成NaHCO3和NaCl,与过量盐酸反应时生成NaCl、H2O、CO2。
【实验假设】
①可燃气体是CO;②可燃气体是H2;③可燃气体是 。
【实验过程】
实验小组按以下流程进行实验(所用试剂均为足量):
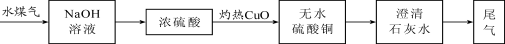
实验中,发现黑色氧化铜变红,且 ,证明水煤气含有H2;
还观察到澄清石灰水变浑浊,证明水煤气中含有另一可燃气体是 。
【实验反思】
根据实验结论,甲同学认为实验应保证安全,防止中毒。对尾气的处理方法是 。
【实验拓展】
(1)实验后,乙同学认为欲检验所用NaOH是否完全消耗,可向溶液中滴入几滴稀盐酸,若没有气体产生,则溶液中还有NaOH剩余。但丙同学认为乙同学的设计是错误的,理由是 ;
(2)(2分)丁同学通过本次实验,结合查阅的资料发现,不用任何其它试剂,只用试管和胶头滴管就可以鉴别稀盐酸和碳酸钠两种无色溶液。正确的鉴别方案及结论是 。
-
水煤气是一种工业上常用的气体燃料,一般用焦炭和水蒸气在高温下反应制得,含有少量的CO2和水蒸气杂质.某化学兴趣小组对水煤气的主要成分进行研究.
【查阅资料】
(1)白色的无水硫酸铜粉末遇水变成蓝色;
(2)Na2CO3与少量盐酸反应生成NaHCO3和NaCl,与过量盐酸反应时生成NaCl,H2O,CO2
【实验假设】
①可燃气只是CO
②可燃气体只是H2
③可燃气体是CO,H2的混合气.
【实验过程】
实验小组按以下流程进行实验(水煤气中CO2,H2O已被充分吸收);

实验中,发现黑色氧化铜变红,且 ________ ,证明水煤气含有H2;还观察到澄清石灰水变浑浊,证明水煤气含有另一可燃气体为 ________
【实验反思】
根据实验结论,甲同学认为实验应保证安全,防止中毒,对尾气的处理方法是 ________ 。
【实验拓展】
(1)实验后,乙同学认为欲检验所用NaOH是否完全消耗,可向溶液中滴入几滴稀盐酸,若没有气体产生,则溶液中还有NaOH剩余,但丙同学认为乙同学的设计是错误的,理由是 ________。
(2)丁同学通过本次实验,结合查阅的资料发现,不用任何其它试剂,只用试管和胶头滴管就可以鉴别稀盐酸和碳酸钠两种无色溶液.正确的鉴别方案及结论是 .
-
水煤气是我国某些地区的一种常用的生活燃料,大量生产水煤气的方法是:将高温水蒸气通入灼热的焦炭(假设焦炭中无其它参加反应的杂质),在700℃﹣800℃之间,生成碳的氧化物和氢气,某兴趣小组为探究水煤气的组成成分,设计了如图所示的装置:

请你和他们一起完成下列活动[提示:①CuSO4(白色)+5H2O═CuSO4•5H2O(蓝色);②假设每一步都充分反应]:
(1)实验中,发现装置B中的澄清石灰水变浑浊,则装置B中发生的一个反应的化学方程式是________.
(2)装置F中的白色粉末变蓝,则装置E发生的一个反应的化学方程式是________.
(3)装置F,G (填“能”或“不能”)调换,其原因是________
(4)实验中,发现装置A、F中的白色粉末变蓝,装置B、G中的澄清石灰水变浑浊,则水煤气的组成成分是________.
-
水煤气是我国某些地区的一种常用的生活燃料,大量生产水煤气的方法是:将高温水蒸气通入灼热的焦炭(假设焦炭中无其它参加反应的杂质),在700℃﹣800℃之间,生成碳的氧化物和氢气,某兴趣小组为探究水煤气的组成成分,设计了如图所示的装置:

请你和他们一起完成下列活动[提示:①CuSO4(白色)+5H2O═CuSO4•5H2O(蓝色);②假设每一步都充分反应]:
(1)实验中,发现装置B中的澄清石灰水变浑浊,则装置B中发生的一个反应的化学方程式是________.
(2)装置F中的白色粉末变蓝,则装置E发生的一个反应的化学方程式是________.
(3)装置F,G (填“能”或“不能”)调换,其原因是________
(4)实验中,发现装置A、F中的白色粉末变蓝,装置B、G中的澄清石灰水变浑浊,则水煤气的组成成分是________.
-
水煤气是我国某些地区的一种常用的生活燃料,大量生产水煤气的方法是:将高温水蒸气通入灼热的焦炭(假设焦炭中无其它参加反应的杂质),在700℃﹣800℃之间,生成碳的氧化物和氢气,某兴趣小组为探究水煤气的组成成分,设计了如图所示的装置:

请你和他们一起完成下列活动[提示:①CuSO4(白色)+5H2O═CuSO4•5H2O(蓝色);②假设每一步都充分反应]:
(1)实验中,发现装置B中的澄清石灰水变浑浊,则装置B中发生的一个反应的化学方程式是________.
(2)装置F中的白色粉末变蓝,则装置E发生的一个反应的化学方程式是________.
(3)装置F,G (填“能”或“不能”)调换,其原因是________
(4)实验中,发现装置A、F中的白色粉末变蓝,装置B、G中的澄清石灰水变浑浊,则水煤气的组成成分是________.
-
焦炭(主要成分是碳单质,杂质不与水反应) 与水蒸气在高温条件下反应,能产 生一种俗称为水煤气的气体燃料,可能还有 H2、CO、CO2。某小组同学设计了如下实验装 置并进行实验。实验后发现 A 装置中溶液变浑浊,D 中的固体由黑色变红色,E 中的固体由 白色变蓝色,G 装置中有水流入烧杯。(已知无水硫酸铜水蒸气变蓝, 碱石灰能吸收二氧化 碳和水蒸气,浓硫酸能吸收水蒸气)

在反应前后对 D、E 装置进行了质量的测量(各步反应均完全),测量结果如下表:

请分析回答下列问题:
(1)水煤气中一定含有 CO2的理由是_______________(用化学方程式表示)。
(2)一定能证明水煤气中有氢气存在的实验现象是______________。
(3)G 装置的作用:①“抽气”;②______________________。
(4)该小组同学通过数据分析,证明水煤气中存在 CO 气体, 请利用上表中的原始数据, 列出数据分析过程(只列式不计算)。__________________。
(5)同学们发现,不通过测量反应前后装置的质量,也可方便的证明 CO 气体的存在。只需增加一个上图中的装置______________(填装置序号)来代替装置 F。
-
焦炭(主要成分是碳单质,杂质不与水反应) 与水蒸气在高温条件下反应,能产生一种俗称为水煤气的气体燃料,可能还有H2、CO、CO2.某小组同学设计了如下实验装置并进行实验。实验后发现 A 装置中溶液变浑浊,D 中的固体由黑色变红色,E 中的固体由 白色变蓝色,G 装置中有水流入烧杯。(已知无水硫酸铜遇水蒸气变蓝,碱石灰能吸收二氧化碳和水蒸气,浓硫酸能吸收水蒸气)。
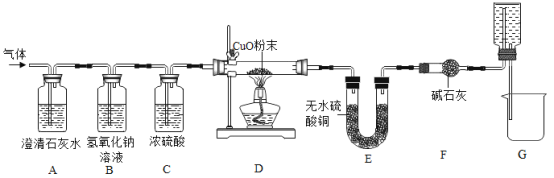
在反应前后对D、E装置进行了质量的测量(各步反应均完全),测量结果如表:
| 装置及药品 | 反应前 | 反应后 |
| D装置中玻璃管与固体的总质量/g | 223.3 | 215.0 |
| E装置中U型管与固体的总质量/g | 260.0 | 267.2 |
请分析回答下列问题:
(1)水煤气中一定含有CO2的理由是_____(用化学方程式表示)。
(2)一定能证明水煤气中有氢气存在的实验现象是_____,_____。
(3)G 装置的作用:①“抽气”;②_____。
(4)该小组同学通过数据分析,证明水煤气中存在 CO 气体,请利用上表中的原始数据,列出数据分析过程(只列式不计算)。_____
(5)同学们发现,不通过测量反应前后装置的质量,也可方便的证明 CO 气体的存在。 需增加一个图中的装置_____(填装置序号)来代替装置 F。
-
工业上用赤热的焦炭和水蒸气在高温条件下生产水煤气,其产物中含有H2O、H2、CO、CO2等物质.课外兴趣小组的同学设计如下实验装置,用来证明水煤气中含有H2和CO,请根据下图回答有关问题:(装置图中省去了铁架台)
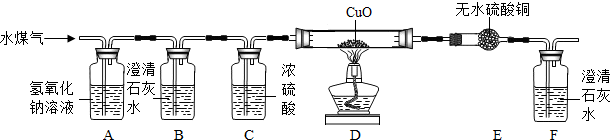
(1)装置B、C的作用分别是______、______.
(2)证明水煤气中有H2的现象是______.
(3)小华同学认为该装置还可用来测定氧化铜中铜、氧元素质量比.他记录了以下两个数据:反应前D装置中氧化铜样品为Xg,反应后F装置增重Yg,则氧化铜中铜、氧元素质量比的计算式为______(用字母表示).若考虑到石灰水中的Ca(OH)2的溶解性较差,则实验结果可能比真实数值______(填“偏大”或“偏小”).
(4)该装置的设计,有一处明显的不足,应如何改进______.
-
(2008•宝山区二模)工业上用赤热的焦炭和水蒸气在高温条件下生产水煤气,其产物中含有H2O,H2,CO,CO2等物质.课外兴趣小组的同学设计如下实验装置,用来证明水煤气中含有H2和CO,请根据下图回答有关问题:(装置图中省去了铁架台)
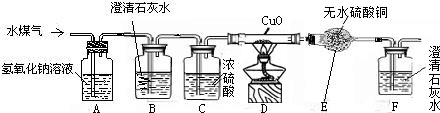
(1)装置A、B、C的作用分别是、、.
(2)证明水煤气中有H2的现象是.
(3)D装置中发生反应的化学方程式为 H2+CuO Cu+H2O CO+CuO
Cu+H2O CO+CuO Cu+CO2
Cu+CO2
(4)该装置的设计,有一处明显的不足,应如何改进?
答:.