-
目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。
(一)铁的广泛应用
(1)认识铁:从宏观看,铁由______组成;从微观看,铁由_________构成。我国在西汉时期就有“曾青得铁则化为铜”之说,其化学方程式是______________________。
(2)生活中:右图是常用的铁锅。用铁锅做炊具,是利用了铁的___________性。防止铁锅生锈,通常采用的方法是____________。

(3)实验室:铁丝在纯净氧气中燃烧的化学反应方程式为__________。铁丝燃烧时火星四射,经研究表明产生火星四射现象的原因,可能是同时生成了某种气体,推测该气体是___________(填化学式)。
(二)铁锈蚀的条件探究
(4)铁在潮湿的空气里容易发生锈蚀,证明水一定参加了反应,必须要做的对比实验是_______(填字母)。
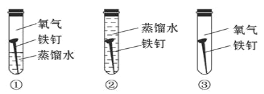
A.①② B.①③ C.②③ D.①②③
(5)一般情况下,两种活动性不同的金属在潮湿的环境中接触时,活动性强的金属首先被腐蚀。造船工业为了避免轮船的钢铁外壳被腐蚀,通常在轮船外壳镶嵌的是_____(填“锌块”或“铜块”)。
(6)如图所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿着细导管慢慢进广口瓶(容积为150mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如下表。(滤纸包等所占体积忽略不计)
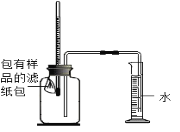
| 序号 | 样品 | 量筒起始读数 | 量筒最终读数 | 所需时间/min |
| 1 | 1g铁粉、0.2 g碳和10滴水 | 100 mL | 72 mL | 约120 |
| 2 | 1g铁粉、0.2g碳、10滴水和少量NaCl | 100 mL | 72 mL | 约70 |
| 3 | | / | / | / |
①铁锈的主要成分是______(写化学式)。
②实验1和2说明NaCl可以_______(填“加快”或“减慢”)铁锈蚀的速率。
③实验开始后广口瓶内温度上升,说明铁锈蚀过程是______(填“放热”或“吸热”)过程。④实验1和3是探究碳对铁锈蚀速率的影响,表格空白处应填写的实验3的样品组成是________。
⑤该装置还可用于测量空气中氧气的体积分数。根据上述数据计算氧气的体积含量是________%(精确到小数点后1位)。
(三)铁的冶炼
(7)某钢铁厂炼铁的主要原料是焦炭、赤铁矿(主要成分为氧化铁)、石灰石等,炼铁设备--高炉结构如图所示,请回答下列问题:
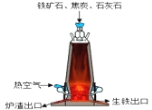
①炼铁的固体原料需预先经过粉碎,其目的是___________。
②炼铁高炉内发生的主要过程如下:
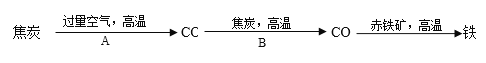
写出步骤写出A、B两步反应的化学方程式:
A:_____________,B:________________
③资料显示,炼铁中焦炭的实际用量远高于理论值,可能原因是______(填字母)。
A.部分焦炭与铁相互熔合,成为生铁中的部分碳元素
B.焦炭转变成一氧化碳后,并不能全部参加反应
C.焦炭在高温下会分解
④某炼铁厂现用100t含氧化铁80%的赤铁矿石炼铁,计算理论上可以炼出含铁96%的生铁的质量__________。(计算结果精确到0.1t)
-
目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。
铁的广泛应用
1.我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理 。
2.铁与铬(Cr)、镍(Ni)等金属熔合可形成“不锈钢”,用不锈钢丝和聚乙烯纤维为
原料可制作耐酸防护服材料。以上叙述中不涉及到 (选填序号)。
A.合金 B.无机非金属材料 C.合成材料 D.复合材料
-
目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。
(一)铁的广泛应用
某品牌的麦片中含微量铁粉,食用后可在胃酸的作用下转化为人体可吸收的铁元素,反应的化学方程式为 。
(二)铁锈成分的探究
(1)右图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是 (选填序号)。
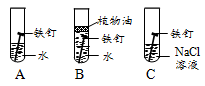
(2).铁生锈的主要过程为:Fe  Fe(OH)2
Fe(OH)2  Fe(OH)3
Fe(OH)3  Fe2O3·xH2O
Fe2O3·xH2O
次要过程为:Fe  FeCO3
FeCO3
写出Fe  Fe(OH)2反应的化学方程式 。
Fe(OH)2反应的化学方程式 。
(3).铁锈组成成分的确定
某铁锈成分为Fe2O3·xH2O和FeCO3。为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用下图装置进行实验。
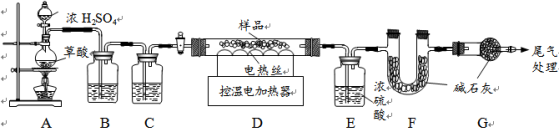
【查阅资料】①Fe2O3·xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2。②温度高于500℃时铁的氧化物才能被CO还原。③碱石灰的主要成分是氢氧化钠和氧化钙。
①装配好实验装置后,首先要 。
②装置A中的反应为:H2C2O4 (草酸)  CO↑+CO2↑+H2O。通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放 (选填序号)。
CO↑+CO2↑+H2O。通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放 (选填序号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
③现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g。
则样品中FeCO3的质量m(FeCO3)= g,x= 。
④若缺少G装置,测得的m(FeCO3) (选填“偏大”、“偏小”、“不变”,下同),
x的值会 。
(三)炼铁过程的探究
⑴.写出工业上用赤铁矿(主要成分Fe2O3)炼铁主要原理的化学方程式 。
【查阅资料】用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO 3FeO+CO2
3FeO+CO2
阶段3:FeO+CO Fe+CO2
Fe+CO2
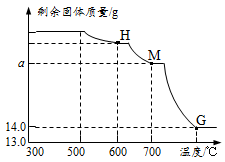
⑵.将上述300℃热分解后的D装置中剩余固体继续分阶段升温,进行CO还原铁的氧化物炼
铁过程的探究。加热时测定D中剩余固体质量随温度变化的曲线如右图所示。图中M点对应的a= 。
-
我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础,生产生活中铁和铁的化合物也有着广泛的应用。
(一)铁的广泛应用
(1)“加铁酱油”中的铁指的是_____(填“单质”或“元素”)。
(2)铁制炊具加热食物,说明铁具有的性质是_____。
(3)铁与铬、镍等金属熔合可形成“不锈钢”,用不锈钢丝和聚乙烯纤维为原料可制作耐酸防护服材料。以上叙述中没有涉及到_____(填字母)。
A 合金 B 无机非金属材料 C 合成材料 D 复合材料
(二)铁锈成分的探究
(1)下图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是_____(选填序号)。
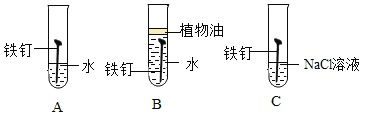
(2)铁生锈的主要过程为:Fe Fe(OH)2
Fe(OH)2 Fe(OH)3
Fe(OH)3 Fe2O3•xH2O
Fe2O3•xH2O
次要过程为:Fe FeCO3
FeCO3
写出Fe→Fe(OH)2反应的化学方程式_____。
(3)铁锈组分的确定
某铁锈成分为Fe2O3•xH2O和FeCO3.为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用下图装置进行实验。
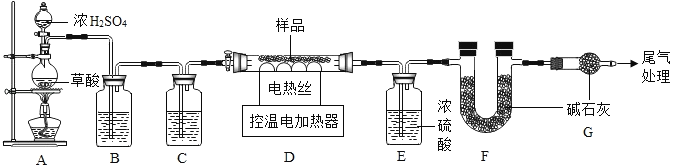
(查阅资料)①Fe2O3•xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2
②温度高于500℃时铁的氧化物才能被CO还原。
(1)装配好实验装置后,首先要_____。
(2)装置A中的反应为:H2C2O4(草酸) CO↑+CO2↑+H2O通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放_____(选填序号)。
CO↑+CO2↑+H2O通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放_____(选填序号)。
a.浓硫酸 b.氢氧化钠溶液
(3)现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g。则样品中FeCO3的质量m(FeCO3)=_____g。
(4)若缺少G装置,Fe2O3•xH2O中x的值会_____。(选填“偏大”、“偏小”、“不变”)
(三)炼铁过程的探究
(1)进行上述实验时,应先点燃A装置中的酒精灯,后对D玻璃管加热,原因是_____。
(2)将上述300℃完全分解后的D装置中剩余固体继续升温,当温度高于500℃时,铁的氧化物全部被CO还原得到铁的质量_____克。(计算过程)
-
目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。
(1)常见鉄的合金有生铁和钢,它们性能不同的原因是_______________。
(2)钢可制成蒸锅,主要利用钢的延展性和________________________ 。
(3)某品牌的麦片中含微量铁粉,食用后可在胃酸的作用下转化为人体可吸收的铁元素,反应的化学方程式为___________。
(4)学校实验室有一批生锈的铁架台,它们生锈的原因是________,写出一个
用酸除锈的化学方程式___________。
-
我国钢铁年产量居世界第一,为国民经济的发展奠定了坚实的基础。
(一)工业炼铁
工业上以空气、铁矿石、石灰石和_____(写名称)为原料来冶炼生铁。石灰石的作用是_____,铁矿石冶炼成铁是一个复杂的过程,某炼铁厂用赤铁矿来炼铁,其炼铁的主要原理是_____(用化学方程式表示)。
(二)铁生锈探究
已知某铁锈的成分为 Fe2O3•xH2O和FeCO3,某兴趣小组的同学在老师指导下测定其组成。
(提出问题1)铁锈的成分是什么?
根据铁锈的成分推测,反应物除了空气中的氧气和水蒸气之外,还有_____参加了反应。
(提出问题2)如何确定此铁锈的组成?
(查阅资料)
①Fe2O3•xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2,Fe2O3在 300℃时不分解。
②本实验条件下,二氧化碳气体的密度为1.80g/L,装置内空气中的水蒸气和二氧化碳对相关数据测定的影响可忽略不计。
(设计方案)兴趣小组的同学设计了如图所示的实验装置(夹持仪器省略)进行实验。
(B装置中药品足量)

(实验步骤)
①连接仪器,并_____。
②取一定量此铁锈样品,准确称得其质量为 5.44g。
③按图所示装入药品,测量并记录相关数据I。
④连接 A、B、C 装置,关闭装置A中活塞,C装置读数后,控制A装置在300℃进行实验。当观察到C装置中有_____现象时,停止加热,待装置冷却后,再次测量并记录相关数据Ⅱ。
(相关数据)
| Ⅰ | Ⅱ |
| A 装置的质量/g | 55.44 | 53.92 |
| B 装置的质量/g | 102.00 | 103.08 |
| C 装置读数/mL | 0 | 244.4 |
(问题讨论)
(1)装置B中浓硫酸的作用是_____。
(2)量气管中水面上放油的目的是_____。
(3)分析计算测量的数据,求FeCO3的质量(写出计算过程)。_________
(4)下列数据组合能确定Fe2O3•xH2O中x的是_____(填序号)。
①A、B 装置反应前后测得的数据
②A、C 装置反应前后测得的数据
③B、C 装置反应前后测得的数据
(拓展)请你列举一条生活中防止菜刀生锈的措施_____。
-
我国钢铁年产量居世界第一,为国民经济的发展奠定了坚实的基础。 工业上以空气、铁矿石、石灰石和_____为原料来冶炼生铁。铁矿石冶炼成铁是一个复 杂的过程,某炼铁厂用赤铁矿来炼铁,其炼铁的主要原理是_____(用化学方程式表示)。
已知某铁锈的成分为 Fe2O3•xH2O 和 FeCO3,某兴趣小组的同学在老师指导下测定其组成。
(提出问题)
(1)根据铁生锈的成分推测,参加反应的除了空气中的氧气和水蒸气之外,还有_____ 参加了反应。
(2)如何确定此铁锈的组成?
(查阅资料)
①Fe2O3•xH2O 失去结晶水温度为 110℃,FeCO3 在 282℃分解为 FeO 和 CO2,Fe2O3 在 300℃时不分解。
②本实验条件下,二氧化碳气体的密度为 1.80g/L,装置内空气中的水蒸气和二氧化碳对相 关数据测定的影响可忽略不计。
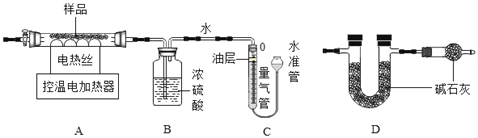
(设计方案)兴趣小组的同学设计了如图所示的实验装置(夹持仪器省略)进行实验。(B、D 装置中药品均足量)
| 
| Ⅰ | Ⅱ |
| A 装置的质量/g | 55.44 | 53.92 |
| B 装置的质量/g | 102.00 | 103.08 |
| C 装置读数/mL | 0 | 244.4 |
(实验步骤)
①连接仪器,并检查装置气密性。
②取一定量此铁锈样品,准确称得其质量为 5.44g。
③按图所示装入药品,测量并记录相关数据 I。
④连接 A、B、C 装置,关闭装置 A 中活塞,C 装置读数后,控制 A 装置在 300℃进行实 验。当观察到C装置中有_____现象时,停止加热,待装置冷却后,再次测量并记录相关数据 II。
(相关数据)(见上表)
(问题讨论)
(1)量气管中水面上油的作用是_____。 分析计算测量的数据,FeCO3的质量为_____g,x 为_____。
(2)下列数据组合能确定样品组成的是_____(填序号)。
①A、B 装置反应前后测得的数据 ②A、C 装置反应前后测得的数据
③B、C 装置反应前后测得的数据
(拓展探究)
小华同学将上述实验中的 C 装置换成 D 装置来测定二氧化碳气体的质量,并根据测定的数 据确定样品的组成。小华同学通过多次反复实验发现,在此实验中,用 C 装置测定二氧化 碳气体的体积与用 D 装置测定二氧化碳气体的质量相比较,当误差数值都为 0.1 时,前者对 实验结果影响小。试通过计算说明原因_____。
-
我国钢铁年产量居世界第一,为国民经济的发展奠定了坚实的基础。工业上以空气、铁矿石、石灰石和______为原料来冶炼生铁。铁矿石冶炼成铁是一个复杂的过程,某炼铁厂用赤铁矿来炼铁,其炼铁的主要原理是______(用化学方程式表示)。
已知某铁锈的成分为 Fe2O3•xH2O 和 FeCO3,某兴趣小组的同学在老师指导下测定其组成。
【提出问题】
(1)根据铁生锈得成分推测,参加反应的除了空气中的氧气和水煤气之外,还有_______ 参加了反应。
(2)如何确定此铁锈的组成?
【查阅资料】
①Fe2O3•xH2O 失去结晶水温度为 110oC,FeCO3 在 282 oC 分解为 FeO 和 CO2,Fe2O3 在 300oC时不分解。
②本实验条件下,二氧化碳气体的密度为 1.80g/L,装置内空气中的水蒸气和二氧化碳对相 关数据测定的影响可忽略不计。
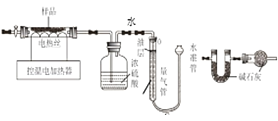
【设计方案】兴趣小组的同学设计了如下图所示的实验装置(夹持仪器省略)进行实验。(B、D 装置中药品均足量)
【实验步骤】
①连接仪器,并检查装置气密性。
②取一定量此铁锈样品,准确称得其质量为 5.44g。
③按上图所示装入药品,测量并记录相关数据 I。
④连接 A、B、C 装置,关闭装置 A 中活塞,C 装置读数后,控制 A 装置在 300 oC 进行实验。当观察到 C 装置中有____________现象时,停止加热,待装置冷却后,再次测量并记 录相关数据 II。
【相关数据】
| Ⅰ | Ⅱ |
| A 装置的质量/g | 55.44 | 53.92 |
| B 装置的质量/g | 102.00 | 103.08 |
| C 装置读数/mL | 0 | 244.4 |
【问题讨论】
(1)量气管中水面上油的作用是___________________。 分析计算测量的数据,FeCO3 的质量为_____________________g,x 为_________________。
(2)下列数据组合能确定样品组成的是_________(填序号)。
①A、B 装置反应前后测得的数据 ②A、C 装置反应前后测得的数据
③B、C 装置反应前后测得的数据
【拓展探究】
小华同学将上述实验中的 C 装置换成 D 装置来测定二氧化碳气体的质量,并根据测定的数 据确定样品的组成。小华同学通过多次反复实验发现,在此实验中,用 C 装置测定二氧化 碳气体的体积与用 D 装置测定二氧化碳气体的质量相比较,当误差数值都为 0.1 时,前者对 实验结果影响小。试通过计算说明原因。___________
-
金属的冶炼为国民经济的发展奠定了坚实的基础,金属活动性顺序在生产和生活中有重要的应用。
(1)铁制品与_____接触易生锈。
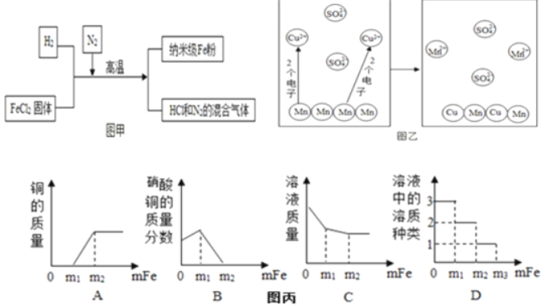
(2)新型材料纳米级 Fe 粉具有广泛的用途,它比普通 Fe 粉更易与氧气反应,其制备工艺流程如图甲所示:请回答下列问题:
请上述制备工艺的化学方程式_____; 在制备纳米级 Fe 粉的工艺流程中,N2的作用是_____。
(3)图乙为Mn和 CuSO4溶液反应的示意图,实际与Mn反应的微粒是_____。
(4)某同学在一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,铁粉先与_____反应,充分反应后,他对反应过程进行了分析,得到了图丙的几个图象(横坐标表示加入铁的质量),其中错误的是_____(填字母序号)。
-
钢铁工业是国家工业的基础,新中国成立后,我国钢铁工业得到飞速的发展.目前,我国钢产量已跃居世界首位.下列关于铁的说法,正确的是( )
A.铁桶可以用来盛装硫酸铜溶液
B.生铁和钢都是铁的合金
C.铁元素是地壳中含量最多的元素
D.铁在氧气中燃烧生成三氧化二铁

Fe(OH)2
Fe(OH)3
Fe2O3·xH2O
FeCO3
Fe(OH)2反应的化学方程式 。

CO↑+CO2↑+H2O。通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放 (选填序号)。
2Fe3O4+CO2
3FeO+CO2
Fe+CO2











