-
碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质。实验小组为探究碘化钾变质原理,进行如下活动。
(查阅资料)
I.对于碘化钾变质的原理,有两种不同的反应:
甲:4KI+O2+2CO2==2K2CO3+2I2乙:4KI+O2+2X=4KOH+2I2
⑴请将上述方程式补充完整,X的化学式是_____。
Ⅱ.KOH与NaOH都属于碱,二者的化学性质相似。
(进行实验)实验1:探究变质的原理
取适量碘化钾固体暴露于空气一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
⑵实验过程中产生的气体是_____。化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是_____。
(进行实验)实验2:探究变质的条件
分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
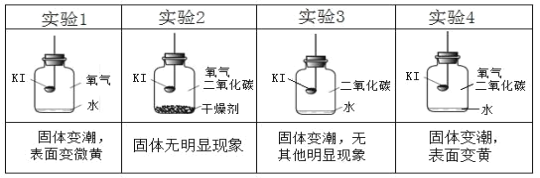
(解释与结论)
⑶对比实验_____(填序号),可以得出KI变质一定与水有关。对比实验_____(填序号),可以得出KI变质一定与氧气有关。
⑷从上述实验可推知,KI变质的条件是_____。
(提出问题)CO2的作用是什么?
(进行实验)
分别取10mL同浓度的KI溶液于3支试管中(试管编号1,2,3),再向试管2中通入CO2,向试管3中滴加几滴盐酸,分别用pH试纸测定溶液的pH;几分钟后,观察溶液的颜色。实验现象记录如下:
| 试管序号 | 1 | 2 | 3 |
| 溶液pH | pH=8 | pH=6 | pH=4 |
| 溶液颜色 | 无色 | 浅黄色 | 黄色 |
(解释与结论)
⑸①pH试纸的使用方法是_____。②CO2在KI变质过程中的作用是_____。
(反思与评价)
⑹探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是_____。
(拓展应用)
测定实验中使用的盐酸中所含溶质的质量分数。
⑺向烧杯中加入质量分数为10%的氢氧化钠溶液40g,再逐滴加入该盐酸,用pH计测定滴加过程中溶液的pH值。图2为滴加盐酸的质量与溶液pH的关系图。
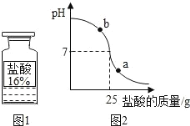
①a点对应的溶液中的溶质为_____(写化学式)。
②盐酸与氢氧化钠溶液反应是_____(选填“吸热”或“放热”)反应。
请以此次测定的数据,列式计算该盐酸的实际溶质质量分数。_____(写出计算过程)
⑻该盐酸的实际溶质质量分数与标签上标出的溶质质量分数不同的可能原因:_____(不考虑测量误差)。
-
碘化钾(KI)保存不当会变质。实验小组进行以下实验探究KI变质的因素。
【提出问题】 KI变质的条件是什么?
【查阅资料】
① KI为白色粉末,暴露在空气中或久置会被氧化为碘(I2)而泛黄变质。
② 碘水中含较多KI时,滴加淀粉溶液显紫色或蓝紫色
【进行实验】分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
| 实验1 | 实验2 | 实验3 | 实验4 |
| 
| 
| 
| 
|
| 固体变潮、表面变微黄 | 固体无明显现象 | 固体变潮、无其他明显现象 | 固体变潮、表面变黄 |
继续实验:取实验1中少量微黄固体溶解,加入淀粉溶液,溶液变紫色。
取实验4中少量黄色固体溶解,加入淀粉溶液,溶液变紫色。
【解释与结论】
(1)实验3的目的是_______。
(2)对比实验_______,可以得出KI变质一定与水有关。
(3)从上述实验可推知,KI变质的条件是_______。
【提出问题2】CO2的作用是什么?
【进行实验】分别取10 mL同浓度的KI溶液于3支试管中,再向试管2中通入CO2,向试管3中滴加几滴盐酸;分别测溶液的pH;几分钟后,观察溶液的颜色;再向试管中滴入淀粉溶液,观察溶液的颜色。实验现象记录如下:
| 试管序号 | 1 | 2 | 3 |
| 溶液pH | pH=8.5 | pH=6.5 | pH=4.5 |
| 溶液颜色 | 无色 | 浅黄色 | 黄色 |
| 滴加淀粉溶液后的颜色 | 无色 | 紫色 | 深紫色 |
较长时间后,观察到试管1中溶液变为紫色。
【解释与结论】
(4)试管1实验的目的是_______。
(5)CO2在KI变质过程中的作用是_______。
【反思与评价】
(6)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是______。
-
碘化钾(KI)保存不当会变质。实验小组进行以下实验探究KI变质的因素。
(提出问题1) KI变质的条件是什么?
(查阅资料)
① KI为白色粉末,暴露在空气中或久置会被氧化为碘(I2)而泛黄变质。
② 碘水中含较多KI时,滴加淀粉溶液显紫色或蓝紫色
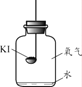
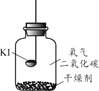
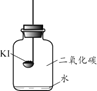
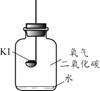
(进行实验)分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
| 实验1 | 实验2 | 实验3 | 实验4 |
| 
| 
| 
| 
|
| 固体变潮、表面变微黄 | 固体无明显现象 | 固体变潮、无其他明显现象 | 固体变潮、表面变黄 |
继续实验:取实验1中少量微黄固体溶解,加入淀粉溶液,溶液变紫色。
取实验4中少量黄色固体溶解,加入淀粉溶液,溶液变紫色。
(解释与结论)
(1)实验3的目的是_______。
(2)对比实验_______,可以得出KI变质一定与水有关。
(3)从上述实验可推知,KI变质的条件是_______。
(4)CO2的作用是______。
-
碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质。化学小组查得以下资料:
Ⅰ.对于碘化钾变质的原理,有两种不同的反应:
甲:4KI+O2+2CO2=2K2CO3+2I2
乙:4KI+O2+2H2O=4KOH+2I2
Ⅱ.KOH与NaOH的化学性质相似。
为探究碘化钾变质原理的合理性,开展以下实验。
(实验过程)
[实验1]取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
①石灰水变浑浊的原因是______(用化学方程式表示)。
②化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是______。
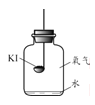
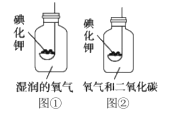
[实验2]如图1所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。

③据此现象,可得出的结论是______。
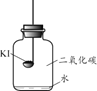
[实验3]按图2所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。
化学小组据此改进实验,很快观察到固体泛黄的现象。
(实验结论)④根据上述实验,化学小组得出结论,碘化钾固体泛黄变质是碘化钾与______共同作用的结果。
-
碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质。
化学小组查得以下资料:
I.对于碘化钾变质的原理,有两种不同的反应:
甲:4KI+O2+2CO2=2K2CO3+2I2 乙:4KI+O2+2H2O=4KOH+2I2
II.KOH与NaOH的化学性质相似。
II.K2CO3与稀疏酸的反应与实验室中制取二氧化碳反应原理类似。为探究碘化钾变质原理的合理性,开展以下实验。
[实验过程]
[实验1]取适量碘化钾固体暴露于空气小一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。(1)化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论,因为有可能是反应乙生成的KOH继续与空气中的二氧化碳反应,写出该反应的化学方程式__________。
[实验2]按图①所示装置进行实验 ,数日后,观察到碘化钾固体无泛黄现象。
(2)据此现象,可得出的结论是__________
[实验3]按图②所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。化学小组图①图②据此改进实验,很快观察到固体泛黄的现象。
(3)简述化学小组改进实验的具体措施:__________。
(4)根据上述实验,化学小组得出结论:碘化钾固体泛黄变质是碘化钾与______共同作用的结果。
-
碘化钾(KI)是白色固体,保存不当会被氧化为单质碘( I2)而泛黄变质。化学兴趣小组查得以下资料:
Ⅰ.对于碘化钾变质的原理,有两种不同的反应:
甲:4 KI+O2 +2CO2= 2K2CO3 +2I2 乙:4KI+ O2 +2H2O=4KOH +2I2
Ⅱ. KOH与NaOH两者的化学性质相似。为探究碘化钾变质原理的合理性,进行以下实验。
【实验过程】
[实验1]取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
(1)石灰水变浑浊的原因是_______________(用化学方程式表示)。
(2)化学兴趣小组的同学认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是_____________________。
[实验2]按甲图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
(3)据此现象,可得出的结论是_________________。
[实验3]按乙图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。

查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。化学兴趣小组据此改进实验,很快观察到固体泛黄的现象。
(4)简述化学兴趣小组改进实验的具体措施:________________。
【实验结论】
(5)根据上述实验,化学兴趣小组得出结论:碘化钾固体泛黄变质是碘化钾与________共同作用的结果。
-
碘化钾(KI)是白色固体,保存不当会被氧化为碘单质(I2)而泛黄变质。取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,将产生的气体通入澄清石灰水中,澄清石灰水变浑浊。
(1)澄清石灰水变浑浊的化学方程式是_____。
(2)碘化钾变质的化学方程式是_____。
-
食品工业中碘化钾(KI)可用作营养增补剂。碘化钾是白色固体,在空气中久置会“泛黄”变质。某实验小组对碘化钾变质后的成分及变质的条件进行探究。
I.探究变质后的固体成分
(查阅资料)淀粉溶液遇碘(I2)变蓝。
(进行实验)
实验 1
| 编号 | ① | ② |
| 操作及现象 | 加热变质后的 KI 固体,黄色消失, 产生的紫色蒸气使淀粉溶液变蓝。 | 向变质后的 KI 固体中滴加稀盐酸, 产生的气体使澄清石灰水变浑浊。 |
II.探究变质的条件
(猜想与假设)常温下,KI 固体“泛黄”变质可能与 O2、CO2 和水蒸气有关。
(进行实验)
实验 2:利用下图装置和表中所列物质分别进行实验,放置相同时间,现象如下表。
| 装置 | 编号 | ① | ② | ③ | ④ |
| 
| 试管中的物质 | O2 和 H2O | O2 和 CO2 | H2O 和 CO2 | O2、CO2 和H2O |
| 固体颜色 | 无明显变化 | 无明显变化 | 无明显变化 | 固体泛黄 |
(解释与结论)
(1)实验 1 中石灰水变浑浊的原因是_________(用化学方程式表示)。
(2)由实验 1 中现象推知,“泛黄”变质后的固体中含有的物质是________。
(3)由实验 2 得出“KI 变质一定与 O2 有关”的结论,依据的两个实验是________(填编号)。
(4)由实验 2 推知,KI“泛黄”变质的条件是_________。
III.依据初步结论,深入探究变质的条件
实验 3:分别取相同浓度的 KI 溶液进行实验,在空气中放置相同时间,现象如下表。
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 实验 | 
| 
| 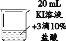
| 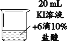
| 
|
| 溶液颜色 | 无色 | 浅黄色 黄色(依次加深) 黄色(依次加深) |
(5)实验 3 中,观察到③~⑤溶液颜色依次加深,推测其原因是________。
(6)由实验 3 推知,KI 固体久置“泛黄”变质过程中,CO2 起到的作用是________。
-
市场上的加碘食盐通常加入的是碘酸钾(KI03),替代了 原来的碘化钾(KI),因为碘化钾容易被氧气氧化为探究不同条件下KI与02的反应,进行如下系列实验。
(查阅资料)
①碘单质(I2)遇淀粉液变蓝。
②部分酸、碱、盐通常在水溶液中以离子形式存在。如:盐酸中存在H+和Cl-。
(进行实验)
实验1将不同浓度的KI溶液置于纯氧中,放置相同时间后观察,现象如下表:
| 装置 | 烧杯中的液体 | 现象 |
| 
| ① 2mL0.15% KI 溶液 +5滴淀粉液 | 无明显变化 |
| ②2mL 1.5% KI 溶液 +5滴淀粉液 | 溶液变蓝 |
| ③2mL 15% KI溶液+5 滴淀粉液 | 溶液变蓝,颜色较② 深 |
实验2将相同浓度的KI溶液加入不同浓度的稀盐酸后置于纯氧中,5分钟后观察,现象如下表:
| 烧杯中的液体 | 现象 |
| 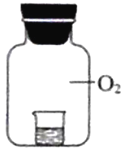
| ④ 2mL 15% KI溶液+5 滴淀粉液+2mL蒸 馏水 | 无明显变化 |
| ⑤2mL 15% KI溶液+5 滴淀粉液+2mL1%盐 酸 | 溶液变蓝 |
| ⑥2mL15% KI溶液+5 滴淀粉液+2 mL 10% 盐酸 | 溶液变蓝,颜色较⑤ 深 |
(解释与结论)
(1)实验1的目的是______________。
(2)实验2中通过对比⑤和⑥,得出的结论是______________。
(3)实验2中,KI在盐酸的作用下与02反应的化学方程式如下,补全该反应的化学方程式:4KI+02+4HCI=4KCI+2_______+_______。
(反思与评价)
(4)实验④中加2mL蒸馏水的作用是______________。
(5)某同学将实验⑤中2mL10%盐酸替换成2mL10%NaCl溶液,5分钟后溶液颜色无明显变化,从离子角度分析,由此得出的结论是_____________________。
-
市场上的加碘食盐通常加入的是碘酸钾(KIO3),替代了原来的碘化(KI),因为碘化钾容易被氧气氧化。为探究不同条件下KI与O2的反应,进行如下系列实验。
(查阅资料)①碘单质(I2)遇淀粉液变蓝。
②部分酸、碱、盐通常在水溶液中以离子形式存在,如:盐酸中存在H+和Cl﹣。
(进行实验)
实验1 将不同浓度的KI溶液置于纯氧中,放置相同时间后观察,现象如下表:
| 装置 | 烧杯中的液体 | 现象 |
| 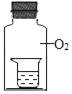 PAGEXXX PAGEXXX
| ①2mL 0.15%KI溶液+5滴淀粉液 | 无明显变化 |
| ②2mL 1.5%KI溶液+5滴淀粉液 | 溶液变蓝 |
| ③2mL 15%KI溶液+5滴淀粉液 | 溶液变蓝,颜色较②深 |
实验2 将相同浓度的KI溶液加入不同浓度的稀盐酸后置于纯氧中,5分钟后观察,现象如表:
| 装置 | 烧杯中的液体 | 现象 |
| 
| ④2mL 15%KI溶液+5滴淀粉液+2mL蒸馏水 | 无明显变化 |
| ⑤2mL 15%KI溶液+5滴淀粉液+2mL1% 盐酸 | 溶液变蓝 |
| ⑥2mL 15%KI溶液+5滴淀粉液+2mL 10% 盐酸 | 溶液变蓝,颜色较⑤深 |
(解释与结论)
(1)实验1的目的是_____。
(2)实验2中通过对比⑤和⑥,得出的结论是_____。
(3)实验2中,KI在盐酸的作用下与O2反应的化学方程式如下,补全该反应的化学方程式:4KI+O2+4HCl=4KCl+2_____+_____。
(反思与评价)
(4)实验④中加2mL蒸馏水的作用是_____。
(5)某同学将实验⑥中2mL10% 盐酸替换成2mL10% NaCl溶液,5分钟后溶液颜色无明显变化,从离子角度分析,由此得出的结论是_____。














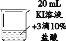
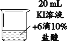



 PAGEXXX
PAGEXXX