-
甲、乙两同学对镁与盐酸反应进行系列研究。
甲、乙两同学取一根镁条,首先用砂纸打磨除去_______,观察到镁条的颜色_______。
研究Ⅰ:镁与盐酸反应过程中的能量变化以及反应速率的变化。
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是_______反应(填“吸热”或“放热”),反应的化学方程式是________。
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,

则t1-t2内反应速率逐渐加快的主要原因是________;
反思:t2-t3内反应速率逐渐减慢的主要原因是_________;
研究Ⅱ:反应后所得溶液的酸碱性探究。
(3)用pH试纸测定反应后所得溶液的酸碱度,发现pH略小于7。
甲同学:猜想Ⅰ:稀盐酸过量;猜想Ⅱ:氯化镁溶液呈弱酸性。
用pH试纸测定酸酸碱度的方法是_______。为验证猜想Ⅱ正确,可以通过查阅资料,也可以取纯净的________溶液并测定其酸碱度。
(4)乙同学将镁片(有剩余)投入适量稀盐酸,待不再产生气泡时立即测量pH,却发现所得溶液pH大于7,溶液冷却到室温后pH小于7。查阅资料发现①Mg+2H2O=Mg(OH)2↓+H2↑,②20℃时SMg(OH)2=0.009g,80℃时 SMg(OH)2=0.0108g。根据资料,乙同学实验中pH发生变化的原因是__________。
-
甲、乙两同学对镁与盐酸反应进行系列研究。甲、乙两同学取一根镁条,首先用砂纸打磨除去_____,观察到镁条的颜色_____。
研究Ⅰ:镁与盐酸反应过程中的能量变化以及反应速率的变化。
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是_____反应(填“吸热”或“放热”),反应的化学方程式是_____。
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则t1﹣t2内反应速率逐渐加快的主要原因是_____;

反思:t2﹣t3内反应速率逐渐减慢的主要原因是_____;
研究Ⅱ:反应后所得溶液的酸碱性探究。
(3)用pH试纸测定反应后所得溶液的酸碱度,发现pH略小于7。
甲同学:猜想Ⅰ:稀盐酸过量;猜想Ⅱ:氯化镁溶液呈弱酸性。用pH试纸测定酸酸碱度的方法是_____。为验证猜想Ⅱ正确,可以通过查阅资料,也可以取纯净的_____溶液并测定其酸碱度。
(4)乙同学将镁片(有剩余)投入适量稀盐酸,待不再产生气泡时立即测量pH,却发现所得溶液pH大于7,溶液冷却到室温后pH小于7.查阅资料发现①Mg+2H2O=Mg(OH)2↓+H2↑,②20℃时SMg(OH)2=0.009g,80℃时 SMg(OH)2=0.0108g。根据资料,乙同学实验中pH发生变化的原因是_____。
-
铁制篮球生锈后,可以采取如下方法处理:首先用砂纸打磨,目的是除去________;再用适量稀盐酸清洗没有除净的物质,发生化学反应的化学方程式为________;最后可采取________的方法防止该篮球架再次生锈.
-
(8分)某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同)。
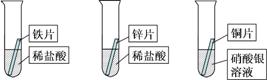
(1)通过观察,甲同学很快判断锌的活动性比铁强。据你分析,甲同学依据的实验现象是。过一会儿,他又发现铜片表面有银白色固体附着,这说明 。
(2)乙同学认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和乙同学一起设计一个实验方案并进行实验,达到探究目的。
(3)通过以上探究,四种金属的活动性由强到弱的顺序是:
-
某研究小组的同学为探究铝、铁、铜、锌的金属活动顺序,设计了如图所示的四个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).

(1)通过观察,甲同学很快判断出锌、铁、铝活动性强弱.据你分析,甲同学依据的实验现象是______.过一会儿,他又发现D中铁片表面有红色固体附着,这说明______.
(2)实验时选用Zn而不用AI、Fe制取氢气的原因是______.
A试管中的实验现象为______.
(3)铝比铁的活动性强,易氧化,但是为什么铝制品耐用而铁制品却容易锈蚀______.
-
某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同)。

(1)通过观察,甲同学很快判断锌的活动性比铁强。据你分析,甲同学依据的实验现象是_____。过一会儿,他又发现铜片表面有银白色固体附着,这说明______,请写出反应方程式________。
(2)乙同学认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和乙同学一起设计一个实验方案并进行实验,达到探究目的。
| 实验步骤 | 实验现象 | 实验结论 |
| ______ | ______ | ______ |
(3)通过以上探究,四种金属的活动性由强到弱的顺序是:_______________。
-
某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).

(1)通过观察,甲同学很快判断锌的活动性比铁强.据你分析,甲同学依据的实验现象是______.过一会儿,他又发现铜片表面有银白色固体附着,这说明______.
(2)乙同学认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和乙同学一起设计一个实验方案并进行实验,达到探究目的.
(3)通过以上探究,四种金属的活动性由强到弱的顺序是:______.
-
某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).

(1)通过观察,甲同学很快判断锌的活动性比铁强.据你分析,甲同学依据的实验现象是______.过一会儿,他又发现铜片表面有银白色固体附着,这说明______.
(2)乙同学认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和乙同学一起设计一个实验方案并进行实验,达到探究目的.
(3)通过以上探究,四种金属的活动性由强到弱的顺序是:______.
-
某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).
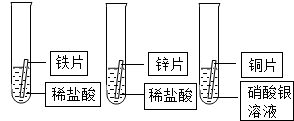
(1)通过观察,甲同学很快判断锌的活动性比铁强.据你分析,甲同学依据的实验现象是______.过一会儿,他又发现铜片表面有银白色固体附着,这说明______.
(2)乙同学认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和乙同学一起设计一个实验方案并进行实验,达到探究目的.
(3)通过以上探究,四种金属的活动性由强到弱的顺序是:______.
-
某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同)。

(1)通过观察,甲同学很快判断锌的活动性比铁强,甲同学依据的实验现象是 ________
(2)③中反应的化学方程式是_______
(3)乙同学认为上述实验不足以得出四种金属的活动性顺序,需再补充一个实验操作是________.








