-
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。某兴趣小组同学对其进行探究。
一、过氧化钙的性质研究
(1)取少量过氧化钙放入试管中,加足量水,产生无色气泡,将带火星的木条伸进试
管中,观察到带火星的木条 ,说明过氧化钙与水反应有氧气生成。
(2)分别取实验(1)静置后的上层清液少量于两支试管中,向其中一支试管中滴入酚酞试液,发现溶液变成红色,说明溶液呈 性;向另一支试管中通入二氧化碳,溶液变浑浊,说明过氧化钙与水反应还有氢氧化钙生成。
结论:过氧化钙和水反应生成氢氧化钙和氧气。
二、过氧化钙的制备研究
实验室用钙盐制备CaO2,其主要实验装置(图1)和流程(图2)如下:
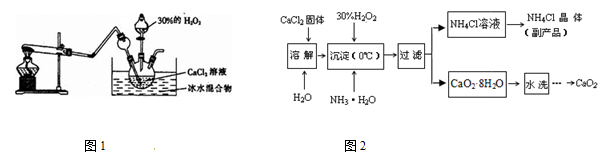
(3)图1试管中的物质是NH4Cl和Ca(OH)2,加热时发生反应生成CaCl2、NH3 和H2O,
反应的化学方程式为 。
(4)“沉淀”时发生的反应为:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl,需
要控制温度在0℃左右,采用的操作是将反应容器放置在 中,反应温度不能过高
的原因是:①防止氨水挥发;② 。
(5)“过滤”所得的副产品NH4Cl可做化肥中的 肥。检验“水洗”已经洗净的方
法是:取最后一次洗涤液少量于试管中, 。
(6)加热分解法是测定CaO2产品纯度的常用方法之一(2CaO2  2CaO+O2↑)。
2CaO+O2↑)。
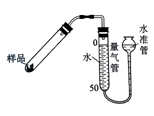
右图是实验室测定产品中CaO2纯度的装置。实验步骤:检查装置的气密性→装填药品0.30g→调节量气管和水准管两边水位相平→加热至不再有气体放出→冷却至室温,调节量气管和水准管两边水位相平→读数→再重复2次,取平均值,计算。(已知:该温度和压强下的O2密度为1.43g/L)
根据下表数据,计算CaO2产品纯度(请写出计算过程)。

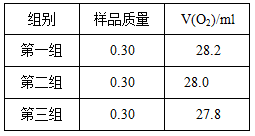
若样品质量用wg表示,反应前称量药品和小试管总质量为mg,反应后在空气中冷却,称量药品和小试管总质量为ng,则CaO2纯度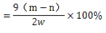 ,此方案测定结果偏小的原因可能是 。
,此方案测定结果偏小的原因可能是 。
[
-
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。某兴趣小组同学对其进行探究。
一、过氧化钙的性质研究
(1)取少量过氧化钙放入试管中,加足量水,产生无色气泡,将带火星的木条伸进试
管中,观察到带火星的木条 ,说明过氧化钙与水反应有氧气生成。
(2)分别取实验(1)静置后的上层清液少量于两支试管中,向其中一支试管中滴入酚酞试液,发现溶液变成红色,说明溶液呈 性;向另一支试管中通入二氧化碳,溶液变浑浊,说明过氧化钙与水反应还有氢氧化钙生成。
结论:过氧化钙和水反应生成氢氧化钙和氧气。
二、过氧化钙的制备研究
实验室用钙盐制备CaO2,其主要实验装置(图1)和流程(图2)如下:
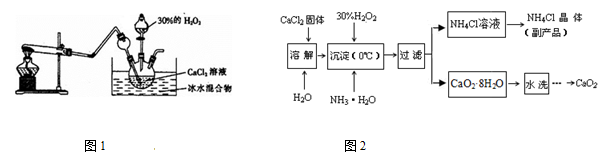
(3)图1试管中的物质是NH4Cl和Ca(OH)2,加热时发生反应生成CaCl2、NH3 和H2O,
反应的化学方程式为 。
(4)“沉淀”时发生的反应为:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl,需
要控制温度在0℃左右,采用的操作是将反应容器放置在 中,反应温度不能过高
的原因是:①防止氨水挥发;② 。
(5)“过滤”所得的副产品NH4Cl可做化肥中的 肥。检验“水洗”已经洗净的方
法是:取最后一次洗涤液少量于试管中, 。
(6)加热分解法是测定CaO2产品纯度的常用方法之一(2CaO2  2CaO+O2↑)。
2CaO+O2↑)。
右图是实验室测定产品中CaO2纯度的装置。实验步骤:检查装置的气密性→装填药品0.30g→调节量气管和水准管两边水位相平→加热至不再有气体放出→冷却至室温,调节量气管和水准管两边水位相平→读数→再重复2次,取平均值,计算。(已知:该温度和压强下的O2密度为1.43g/L)
根据下表数据,计算CaO2产品纯度(请写出计算过程)。
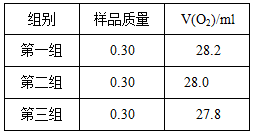
若样品质量用wg表示,反应前称量药品和小试管总质量为mg,反应后在空气中冷却,称量药品和小试管总质量为ng,则CaO2纯度 ,此方案测定结果偏小的原因可能是 。
,此方案测定结果偏小的原因可能是 。
[
-
过氧化钙(CaO2)是一种重要的化工产品,能杀菌消毒,广泛用于果蔬保鲜、 空气净化、污水处理等方面。某兴趣小组同学对其进行了有关探宄。
(查阅资料)
(1)过氧化钙是白色、无毒、难溶于水的白色粉末。
(2) 。
。
(3) ;二氧化锰与稀盐酸不反应。
;二氧化锰与稀盐酸不反应。
(探宄1)验证过氧化钙受热分解的产物。
(1)取少量纯净的过氧化钙放入试管中充分加热,将带火星的木条伸入试管,可观察到带火星的木条_______。
(2)待(1)中试管冷却,取管中少量固体加水充分搅拌,静置,向上层清液中滴加几滴酚酞试液,可观察到溶液变成_________色。
(探宄2)测定产品中过氧化钙的质量分数(假设过氧化钙产品中只含有氧化钙杂质)。
(实验装置)
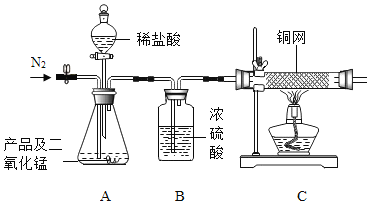
(实验步骤)
①连好装置并检查装置的气密性,在锥形瓶中放入4g该产品;②实验前称量C中铜网的质量;③先缓慢通入氮气,一段时间后加热铜网至红热;再缓慢滴入过量稀盐酸,直至A中样品完全反应;④继续缓慢通入氮气,一段时间后停止加热,待C中铜网冷却后,停止 通入氮气;⑤再次称量C中铜网的质量,发现比反应前増重0.8g。
(实验结论)
(1)A中二氧化锰的作用是____________________。
(2)C中铜网发生反应的化学方程式为______________。
(3)该产品中过氧化钙的质量分数为___________。
(拓展提升)若A中样品完全反应后,立即停止通氮气并熄灭酒精灯,待C中铜网冷却后称量其质量。你认为该操作对测定产品中过氧化钙的质量分数是否有影响?_____________。(选填“是”或“否”,并说明理由)。
-
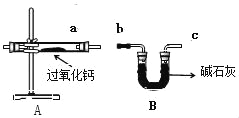
过氧化钙(CaO2)是一种白色无毒的固体,微溶于水,溶于酸,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法:
(Ⅰ)氨气的制备
(查阅资料)
①实验室常用加热氯化铵和熟石灰固体混合物的方法制取氨气;
②氨气极易溶于水,所得溶液称为氨水。
③碱石灰的主要成分是氧化钙和氢氧化钠的混合物。
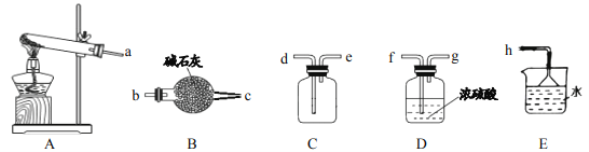
(1)实验室制取氨气的化学方程式_____。
(2)如需收集一瓶干燥的氨气,请选择上图中合适的装置,装置连接顺序为:a→_____→_____→_____→_____→h(按气流方向,用小写字母填空)。
(Ⅱ)碳酸钙的制备
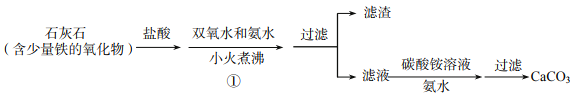
(1)铁的氧化物主要成分为氧化铁,写出氧化铁和盐酸反应的化学方程式_____。
(2)步骤①加入双氧水的目的是使溶液中的Fe2+转化为Fe3+,加入氨水使铁离子形成沉淀,则滤渣的主要成分为_____(填化学式),小火煮沸的作用是使沉淀颗粒长大,有利于_____。
(Ⅲ)过氧化钙的制备
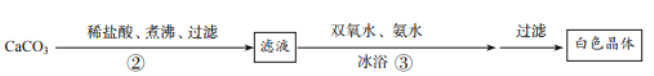
(1)步骤②的具体操作为逐滴加入稀盐酸直至过量。将溶液煮沸的作用是_____。
(2)步骤③是氯化钙和过氧化氢反应制取过氧化钙,则反应的化学方程式为_____,加入氨水的目的是_____,该反应需要在冰浴下进行,原因是_____。
(3)某同学认为,将石灰石煅烧后,直接加入双氧水反应,过滤后即可得到过氧化钙产品,使用该制备工艺的主要缺点是_____。
(4)已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
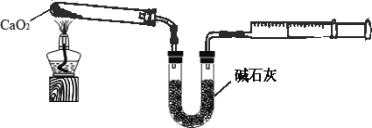
若所取产品质量是0.5g,测得气体体积为60.0mL(该温度下氧气密度为1.6g/L),则产品中CaO2的质量分数为多少_____(写出计算过程)?
-
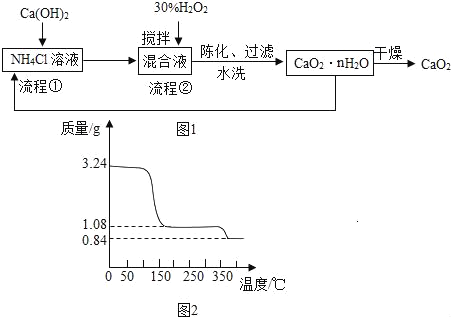
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,加热至350℃左右开始分解放出氧气。过氧化钙能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。其工业制备的主要流程如图1:
已知:CaCl2+H2O2+2NH3+nH2O=CaO2•nH2O↓+2NH4Cl。
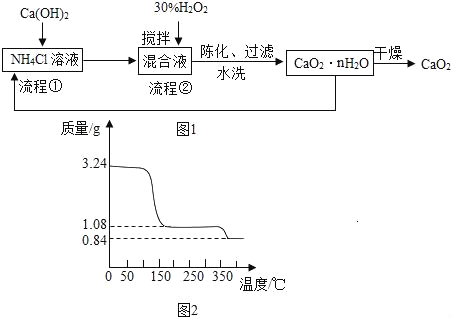
(1)搅拌的目的是_____。
(2)流程②中没有采用加热措施的可能原因是_____。
(3)整个流程中,除水外还可以循环使用的物质是_____。
(4)过滤操作中需要的玻璃仪器有漏斗、烧杯和_____,该仪器的作用是_____,检验CaO2•nH2O是否洗涤干净的方法是_____。
(5)取上述制得的CaO2•nH2O晶体进行热重分析,其热分解时晶体的质量分数随温度变化的曲线如图2,通过计算可得出n=_____。
-
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,加热至350℃左右开始分解放出氧气。过氧化钙能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。其工业制备的主要流程如图1:
已知:CaCl2+H2O2+2NH3+nH2O=CaO2•nH2O↓+2NH4Cl。
(1)搅拌的目的是_____。
(2)流程②中没有采用加热措施的可能原因是_____。
(3)整个流程中,除水外还可以循环使用的物质是_____。
(4)过滤操作中需要的玻璃仪器有漏斗、烧杯和_____,该仪器的作用是_____,检验CaO2•nH2O是否洗涤干净的方法是_____。
(5)取上述制得的CaO2•nH2O晶体进行热重分析,其热分解时晶体的质量分数随温度变化的曲线如图2,通过计算可得出n=_____。
-
过氧化钙(CaO2)是一种白色、无毒的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:

已知反应④的化学方程式为:CaCl2+2NH3+H2O2+8H2O=CaO2·8H2O↓+2NH4Cl请完成下列问题:
(1)在加热的条件下,写出反应③的化学方程式:_____。
(2)从经济成本的角度去分析工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为_____。
(3)若在实验室里进行过滤操作,下列仪器中不需要的是_____(填字母标号)。
A 漏斗 B 烧瓶 C 玻璃棒 D 烧杯
(4)可循环使用的物质是_____。
(5)CaO2固体可用于鱼塘的增氧剂,又能杀菌消毒,请用化学方程式表示其反应的原理:_____。
-
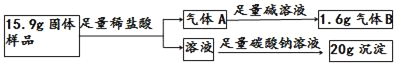
过氧化钙(CaO2)是一种用途广泛的优良供氧剂,白色固体,微溶于水,可用于鱼类养殖。某兴趣小组探究过氧化钙的部分化学性质,装置如图。
(资料检索)
Ⅰ.过氧化钙与水反应 2CaO2+2H2O=2Ca(OH)2+O2↑
Ⅱ.过氧化钙与足量的稀盐酸反应2CaO2+4HCl=2CaCl2+2H2O+O2↑
(实验探究)
| 实验步骤 | 实验现象 | 实验结论 |
| 实验一 | 1、向玻璃管中加入过氧化钙,将A左侧管口换成无孔塞,加热到315℃,并保持一段时间直至完全反应,用带火星的木条放在a导管口 | 木条复燃 | 有 _____生成 |
| 2、待玻璃管冷却,取管中少量白色固体,①加适量水充分搅拌;②滴几滴酚酞试液 | ① _____②变红色 | 固体是氧化钙 |
| 实验二 | 1、换装过氧化钙,将A左侧管口换成单孔塞,连接a,b导管,通入二氧化碳气体充分反应,同时把带火星的木条放在c导管口。 | 木条复燃,固体仍是白色 | |
| 2、取适量玻璃管中白色固体,_____。 | _____ | 固体是碳酸钙 |
(解释与结论)
(1)由实验一可知,过氧化钙受热会分解,写出步骤2中白色固体与水反应的化学方程式:_____。
(2)由实验二可知,过氧化钙能与二氧化碳发生反应,写出其化学方程式:_____。
(3)B装置中碱石灰的作用是:_____
(分析与计算)
现有一敞口在空气中的过氧化钙固体样品,通过下列实验,探究其中各成分的质量比为_____。
-
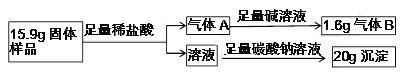
过氧化钙(CaO2)是一种用途广泛的优良供氧剂,白色固体,微溶于水,可用于鱼类养殖。某兴趣小组探究过氧化钙的部分化学性质,装置如下图。
(资料检索)
Ⅰ.过氧化钙与水反应 2CaO2+2H2O=2Ca(OH)2+O2↑
Ⅱ.过氧化钙与足量的稀盐酸反应2CaO2+4HCl=2CaCl2+2H2O+O2↑

(实验探究)

________________ ___________________ ________________ ____________
(解释与结论)
⑴由实验一可知,过氧化钙受热会分解,写出步骤2中白色固体与水反应的化学方程式:_____。
⑵由实验二可知,过氧化钙能与二氧化碳发生反应,写出其化学方程式:________。
⑶B装置中碱石灰的作用是:_________
(分析与计算)
现有一敞口在空气中的过氧化钙固体样品,通过下列实验,探究其中各成分的质量比为 _______。
-
工业产品过氧化钙晶体(CaO2·8H2O)较稳定,呈白色,微溶于水,广泛用于环境杀菌、消毒。以贝壳(主要成分是 CaCO3,杂质不参加反应也不溶于水)为原料制备 CaO2的流程如下:
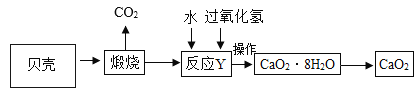
(1)CaO2中氧元素的化合价为___________;
(2)上述流程中将过氧化钙晶体从溶液中分离的步骤是过滤,该操作中用到的玻璃仪器有玻璃棒、 烧杯和_______________,其中玻璃棒的作用是_______________;
(3)反应 Y 需要在低温条件下进行,其原因是_________________;
(4)获取的 CaO2 中常含有 Ca(OH)2 杂质,原因是_______________(用化学方程式表示)。




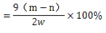 ,此方案测定结果偏小的原因可能是
,此方案测定结果偏小的原因可能是


 ,此方案测定结果偏小的原因可能是
,此方案测定结果偏小的原因可能是











