-
以菱锌矿(主要成分是ZnCO3,杂质为Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO4•7H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:
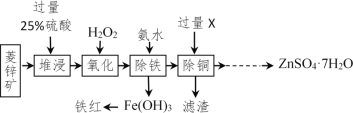
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是_____________________;
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸质量为_____g(列出算式即可),需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和________,此处玻璃棒的作用是____ ;
(3)物质X是___________,除铜时发生的反应属于________________反应(填基本反应类型);
(4)“氧化”中加入H2O2的目的是在硫酸的作用下将溶液中的FeSO4转化成Fe2(SO4)3,反应的化学方程式:_______________。
(5)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶、过滤、洗涤和低温烘干;
(6)除铁过程中,反应温度、溶液pH对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
| 编号 | 反应温度/℃ | 溶液pH | 除铁率/% |
| a | 30 | 2 | 91.5 |
| b | 30 | 2.5 | 93.3 |
| c | 40 | 2.5 | 95.1 |
| d | 40 | 3.1 | Y |
| e | 50 | 3.1 | 99.5 |
①实验____和实验_____对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;
②实验a和实验b对比,得到结论是____________;
③表中Y的值可能为_____________(填编号)
A 93.4 B 94.1 C 97.8 D 99.6
④最佳的除铁条件为反应温度______℃,溶液pH_________。
-
以菱锌矿(主要成分是ZnCO3,杂质为Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO4•7H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:
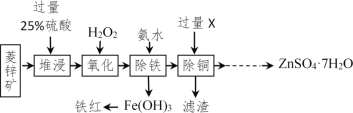
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是_____________________;
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸质量为_____g(列出算式即可),需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和________,此处玻璃棒的作用是____ ;
(3)物质X是___________,除铜时发生的反应属于________________反应(填基本反应类型);
(4)“氧化”中加入H2O2的目的是在硫酸的作用下将溶液中的FeSO4转化成Fe2(SO4)3,反应的化学方程式:_______________。
(5)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶、过滤、洗涤和低温烘干;
(6)除铁过程中,反应温度、溶液pH对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
| 编号 | 反应温度/℃ | 溶液pH | 除铁率/% |
| a | 30 | 2 | 91.5 |
| b | 30 | 2.5 | 93.3 |
| c | 40 | 2.5 | 95.1 |
| d | 40 | 3.1 | Y |
| e | 50 | 3.1 | 99.5 |
①实验____和实验_____对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;
②实验a和实验b对比,得到结论是____________;
③表中Y的值可能为_____________(填编号)
A 93.4 B 94.1 C 97.8 D 99.6
④最佳的除铁条件为反应温度______℃,溶液pH_________。
-
以菱锌矿(主要成分是ZnCO3,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4﹒7H2O),回答下列问题:
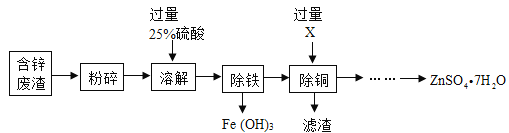
(1)“溶解”时矿石中主要成分发生反应的化学方程式为__________________。若该过程需要的25%的稀硫酸,用一定浓度的浓硫酸进行配制,需要用到的仪器有胶头滴管、玻璃棒、烧杯和___________,其中玻璃棒的作用是_____________________。
(2)“除铁”中溶液的酸碱度对除铁效果的影响如图所示,由图可知,除铁时pH应控制在_________为宜;

(3)物质X是___________,滤渣的成分是_______________。
(4)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶,过滤、洗涤和低温烘干。
-
(15分)含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途
I.以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。
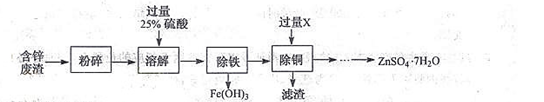
(1)粉碎的目的是 。
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管﹑玻璃棒﹑ 和 ,此处玻璃棒的作用是 。
(3)物质X是 ,滤渣中含有的金属单质有 ,除铜时发生的反应属于 反应(填基本反应类型)。
(4)流程中获得七水硫酸锌前省略的操作是 ﹑冷却结晶﹑ 洗涤和低温烘干。
(5)某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式 。
(6)除铁过程中,温度pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在 ℃为宜,pH应控制在 为宜。
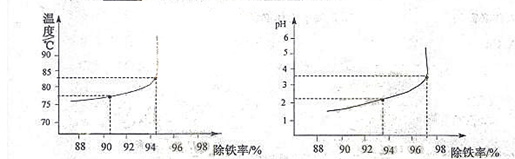
II.以某菱锌矿(ZnCO3含量为62.5%)为原料制备锌的原理如下(假设杂质不参加反应):
 则100吨这样的菱锌矿理论上最多制得锌多少吨?(写出计算过程)
则100吨这样的菱锌矿理论上最多制得锌多少吨?(写出计算过程)
-
含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途,以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下:
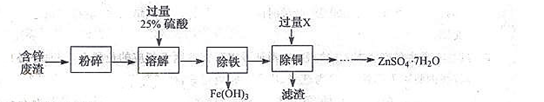
(1)粉碎的目的是 。
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,配制溶液时需要的玻璃仪器有胶头滴管﹑玻璃棒﹑量筒和 。
(3)物质X是 。
-
含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O的流程如下。
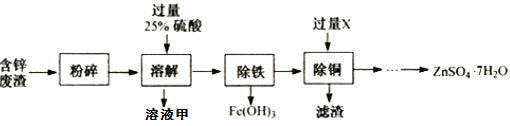
下列说法正确的是
A. 粉碎的目的是增大接触面积,加快反应速率,充分反应。
B. 溶液甲中共含有三种阳离子。
C. 物质X可以是铁,滤渣中含有的金属单质有铁和铜,除铜时发生的反应属于置换反应。
D. 流程中获得七水硫酸锌前省略的操作是:加热浓缩,冷却结晶,过滤,洗涤低温烘干。
-
含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4•7H2O)的流程如图1.
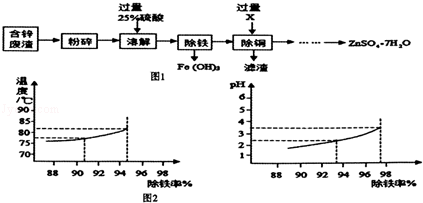
(1)粉碎的目的是 .
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、 和 ,此处玻璃棒的作用是 .
(3)物质X是 ,滤渣中含有的金属单质有 ,除铜时发生的反应属于 反应(填基本反应类型)
(4)流程中获得七水硫酸锌前省略的操作是 、冷却结晶、 、洗涤和低温烘干.
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比21:8的氧化物,该氧化物的化学式 .
(6)除铁过程中,温度、pH对除铁效果的影响分别对如图2所示.由图2可知,除铁时温度应控制在 ℃为宜,pH应控制在 .为宜.
-
以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4•7H2O)的流程如图。
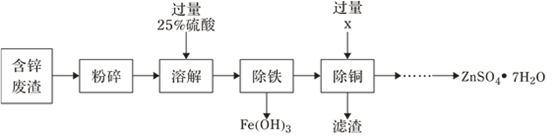
(1)粉碎的目的是_________;
(2)物质X是______,滤渣中含有金属单质有______,除铜时发生的反应方程式为______;
(3)流程中获得七水硫酸锌前省略的操作是______、冷却结晶、_____、洗涤和低温烘干;
a.蒸发结晶 b.加热浓缩 c.加水稀释 d.过滤
(4)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21∶8的氧化物,该氧化物的化学式为________________。
-
以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4•7H2O)的流程如图。
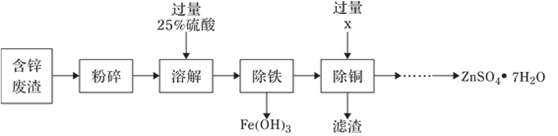
(1)粉碎的目的是_________;
(2)物质X是______,滤渣中含有金属单质有______,除铜时发生的反应方程式为______;
(3)流程中获得七水硫酸锌前省略的操作是______、冷却结晶、_____、洗涤和低温烘干;
a.蒸发结晶 b.加热浓缩 c.加水稀释 d.过滤
(4)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21∶8的氧化物,该氧化物的化学式为________________。
-
以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。
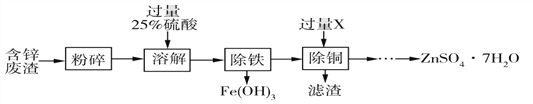
(1)写出“溶解”时发生的其中一个反应方程式___________________________。
(2)物质X是________,滤渣中含有的金属单质有_________。
(3)流程中获得七水硫酸锌前省略的操作是________﹑冷却结晶﹑_____、洗涤和低温烘干。











