-
某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中c(H+)=1×10-3mol·L-1。下列对该溶液的叙述不正确的是
A. 该温度高于25 ℃
B. 由水电离出来的H+的浓度为1×10-11mol·L-1
C. 加入NaHSO4晶体抑制水的电离
D. 取该溶液加水稀释100倍,溶液中的c(OH-)增大
难度: 中等查看答案及解析
-
下列方法中,可以使0.10 mol·L− 1 氨水中NH3·H2O的电离程度减小的是
A. 加入少量0.10 mol·L− 1盐酸 B. 加水稀释
C. 加入少量0.10 mol·L− 1NaOH溶液 D. 加入少量NaCl固体
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 0.1 mol·L-1的CH3COOH溶液中,由水电离的c(H+)为10-13mol·L-1
B. pH=2与pH=1的CH3COOH溶液中c(H+)之比为1∶10
C. 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量不相同,醋酸消耗NaOH的物质的量多
D. 水的离子积常数KW随着温度的升高而增大,说明水的电离是吸热反应
难度: 中等查看答案及解析
-
在一定温度下,向一个2L的真空密闭容器中(预先装入催化剂)通入1mol N2和3mol H2,发生反应:N2+3H2
 2NH3。经过一段时间后,测得容器内压强是起始的0.9倍,在此时间内,H2的平均反应速率为0.1mol/(L·min),则所经过的时间为
2NH3。经过一段时间后,测得容器内压强是起始的0.9倍,在此时间内,H2的平均反应速率为0.1mol/(L·min),则所经过的时间为A. 2min B. 3min C. 4min D. 5min
难度: 中等查看答案及解析
-
0.1mol/LNa2S2O3溶液和0.1mol/LH2SO4溶液各5mL,与10mL水混合,反应速率为v1mol/(L·s);0.2mol/LNa2S2O3溶液和0.2mol/LH2SO4溶液各5mL,与20mL水混合,反应速率为v2mol/(L·s)。则v1和v2的关系是
A. v1<v2 B. v1>v2 C. v1=v2 D. 不能肯定
难度: 中等查看答案及解析
-
设C+CO2
 2CO(正反应吸热),反应速率为v1,N2+3H2
2CO(正反应吸热),反应速率为v1,N2+3H2 2NH3(正反应放热),反应速率为v2,对于上述反应,当温度升高时v1和v2的变化情况是( )
2NH3(正反应放热),反应速率为v2,对于上述反应,当温度升高时v1和v2的变化情况是( )A.同时增大 B.同时减小
C.v1增大,v2 减小 D.v1减小,v2增大
难度: 中等查看答案及解析
-
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)
 Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )A. 混合气体的密度不再变化
B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等
D. 单位时间内生成1 mol Y的同时生成2 mol X
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:
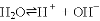 ,下列叙述正确的是
,下列叙述正确的是A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
D. 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大
难度: 中等查看答案及解析
-
常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH
 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是A.加入水时,平衡向右移动,CH3COOH电离常数增大
B.加入少量CH3COONa固体,平衡向右移动
C.加入少量NaOH固体,平衡向右移动,c(H+)减小
D.加入少量pH=5的硫酸,溶液中c(H+)增大
难度: 中等查看答案及解析
-
25℃时不断将水滴入0.1mol·L-1的氨水中,下列图像变化合理的是( )
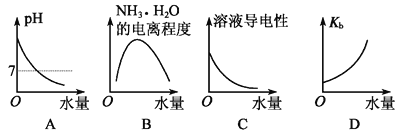
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将0.1mol·L-1的下列物质的水溶液,从常温加热到90 ℃,溶液的pH不变的是
A.氯化钠 B.硫酸 C.氢氧化钾 D.硫酸铵
难度: 中等查看答案及解析
-
常温,某溶液中由水电离产生的c(H+)=10—12,则下列各组离子在该溶液中一定可以大量共存的是( )
A. K+、Na+、AlO2—、Cl— B. Na+、Cl—、SO42—、HCO3—
C. NH4+、Na+、NO3—、SO42— D. Ba2+、Na+、Cl—、NO3—
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. pH<7的溶液一定呈酸性
B. 0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH﹣)相等
C. pH为1的盐酸的c(H+)是pH为3的盐酸的100倍
D. Na2CO3溶液中,c(Na+)是c(CO32﹣)的两倍
难度: 简单查看答案及解析
-
常温下,将pH=8和pH=10的两种氢氧化钠溶液等体积混合,混合后溶液中c(H+)均为
A.
 mol·L-1 B. (10-8+10-10)mol·L-1
mol·L-1 B. (10-8+10-10)mol·L-1C. (10-14-5×10-5) mol·L-1 D. 2×10-10 mol·L-1
难度: 中等查看答案及解析
-
已知次磷酸(H3PO2)为一元酸,欲证明它是弱电解质,下列操作方法不正确的是
A. 用物质的量浓度相同的NaCl溶液和NaH2PO2溶液进行导电性实验,比较灯泡的亮度
B. 用一定浓度的NaOH溶液分别滴定等体积、等pH的盐酸和次磷酸溶液,比较消耗碱液的体积
C. 加热滴有酚酞试液的NaH2PO2溶液,溶液颜色变深
D. 常温下,稀释0.1mol·L-1次磷酸溶液至原溶液体积的100倍,测得pH在4~5之间
难度: 中等查看答案及解析
-
1000K时反应C(s)+2H2(g)
 CH4(g)的K=8.28×107(mol·L-1)-1,当各气体物质的量浓度分别为c(H2) = 0.7 mol·1-1、c(CH4) = 0.2 mol·L-1、c (N2) = 0.1 mol·L-1时,上述反应
CH4(g)的K=8.28×107(mol·L-1)-1,当各气体物质的量浓度分别为c(H2) = 0.7 mol·1-1、c(CH4) = 0.2 mol·L-1、c (N2) = 0.1 mol·L-1时,上述反应A. 正向移动 B. 逆向移动 C. 达到平衡 D. 不一定
难度: 中等查看答案及解析
-
当把晶体N2O4放入密闭容器中气化,并建立了N2O4(g)
 2NO2(g)平衡后,保持温度不变,再通入若干N2O4气体,待反应达到新的平衡时,则新平衡与旧平衡相比,c2(NO2)/c(N2O4)值( )
2NO2(g)平衡后,保持温度不变,再通入若干N2O4气体,待反应达到新的平衡时,则新平衡与旧平衡相比,c2(NO2)/c(N2O4)值( )A. 变大 B. 不变 C. 变小 D. 无法确定
难度: 简单查看答案及解析
-
在一恒定的容器中充入2molA和1molB发生反应:2A(g)+ B(g)
 xC(g),达到平衡后,C的体积分数为ω%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为ω%,则x值为
xC(g),达到平衡后,C的体积分数为ω%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为ω%,则x值为A. 只能为2 B. 只能为3
C. 可能是2,也可能是3 D. 无法确定
难度: 中等查看答案及解析
-
在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)
 2HI(g)。已知H2和I2的起始浓度均为0.10 mol/L,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0.20 mol/L时,则平衡时H2的浓度(mol/L)是
2HI(g)。已知H2和I2的起始浓度均为0.10 mol/L,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0.20 mol/L时,则平衡时H2的浓度(mol/L)是A. 0.16 B. 0.08 C. 0.06 D. 0.04
难度: 中等查看答案及解析
-
向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g)
 CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是A. 0.5molCO+2molH2O(g)+1molCO2+1molH2
B. 1molCO+1molH2O(g)+1molCO2+1molH2.
C. 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D. 0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
难度: 中等查看答案及解析
-
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g)
 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )A. 该反应的化学平衡常数表达式是
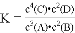
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
难度: 中等查看答案及解析
-
在密闭容器中,反应2X(g)+Y2(g)
 2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是
2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是
A. 图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2
B. 图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C. 图Ⅱ中,t时间是增大了压强
D. 图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
难度: 中等查看答案及解析
-
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g)
 N2(g)+O2(g)K1=1×1030
N2(g)+O2(g)K1=1×10302H2(g)+O2(g)
 2H2O(g)K2=2×1081
2H2O(g)K2=2×10812CO2(g)
 2CO(g)+O2(g)K3=4×10-92
2CO(g)+O2(g)K3=4×10-92以下说法正确的是
A. 常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B. 常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C. 常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D. 以上说法都不正确
难度: 简单查看答案及解析
-
已知40℃时水的离子积常数为Kw。该温度下, 将浓度为 a mol/L的一元酸HA与 b mol/L的一元碱BOH等体积混合,该溶液呈中性时,下列叙述不正确的是
A. a=b, pH=7 B. 混合溶液的c(H+)=c(OH-)
C. 混合溶液中,c(B+) =c(A-) D. 混合溶液中,c(OH-)=
 mol/L
mol/L难度: 中等查看答案及解析
-
向恒温、恒容(2L)的密闭容器中充入2molSO2和一定量的O2发生反应:2SO2(g)+O2(g)
 2SO3(g) △H= —197.74KJ.mol-1,4min后达到平衡,这时c(SO2)=0.2mol.L-1,且SO2与O2的转化率相等。下列说法中不正确的是
2SO3(g) △H= —197.74KJ.mol-1,4min后达到平衡,这时c(SO2)=0.2mol.L-1,且SO2与O2的转化率相等。下列说法中不正确的是A. 达到平衡时再充入2mol SO2反应的△H保持不变。
B. 用O2表示4min内的反应速率为0.1mol·(L·min)-1
C. 再向容器中充入1mol SO3,达到新平衡,n(SO2)∶n(O2)=2∶1
D. 4min后,若升高温度,平衡向逆反应方向移动,平衡常数K增大
难度: 中等查看答案及解析
 CO(g)+H2O(g)
CO(g)+H2O(g) C(g)
C(g) HCO3-+H+的平衡常数K1=_______。(已知:10-5.6=2.5×10-6,保留一位小数);
HCO3-+H+的平衡常数K1=_______。(已知:10-5.6=2.5×10-6,保留一位小数);