-
已知:反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH1 的平衡常数为K1;
FeO(s)+CO(g) ΔH1 的平衡常数为K1;
反应②Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH2 的平衡常数为K2。
FeO(s)+H2(g) ΔH2 的平衡常数为K2。
反应③CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3 的平衡常数为K3。
CO(g)+H2O(g) ΔH3 的平衡常数为K3。
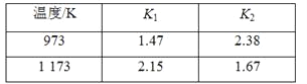
不同温度时K1、K2的值如下表,下列说法正确的是 ( )
| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
 A.K3= K1-K2 B.K3= K1+ K2 C.ΔH3 > 0 D.ΔH3 < 0
A.K3= K1-K2 B.K3= K1+ K2 C.ΔH3 > 0 D.ΔH3 < 0
-
已知:反应①Fe(s)+CO2(g) ⇌FeO(s)+CO(g) ΔH1的平衡常数为K1;
反应②Fe(s)+H2O(g) ⇌ FeO(s)+H2(g) ΔH2的平衡常数为K2。
反应③CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH3的平衡常数为K3。
不同温度时K1、K2的值如下表,下列说法正确的是 ( )
A.K3=K1-K2
B.K3=K1+K2
C.ΔH3>0
D.ΔH3<0
-
现有三个反应:
反应① Fe(s)+H2O(g) FeO(s)+H2(g) △H1 平衡常数为K1
FeO(s)+H2(g) △H1 平衡常数为K1
反应② CO(g)+H2O(g) H2(g)+CO2(g) △H2 平衡常数为K2
H2(g)+CO2(g) △H2 平衡常数为K2
反应③ Fe(s)+CO2 (g) FeO(s)+CO(g) △H3 平衡常数为K3
FeO(s)+CO(g) △H3 平衡常数为K3
在不同温度下,部分K1、K2的值如下:
| T/℃ | 700 | 800 |
| K1 | 2.38 | 2.56 |
| K2 | 0.80 | |
(1)K1的表达式为________;根据反应①、②、③推导出K1、K2、K3的关系式K3=______。
(2)要使反应①在一定条件下建立的平衡右移,可采取的措施有_________。(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少FeO的量
(3)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应②,反应过程中测定的部分数据见下表:
| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |
①反应在2 min内的平均速率为v(H2O)=________________;
②800℃时,K2的值为_______________;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率_______________(填“增大”或“减小”或“不变”)。
(4)由以上信息推断反应③正反应方向为________(填“放热”或“吸热”)反应。
-
设反应①Fe(s) + CO2(g)  FeO(s) + CO(g) 的平衡常数为K1,反应②Fe(s) + H2O(g)
FeO(s) + CO(g) 的平衡常数为K1,反应②Fe(s) + H2O(g) FeO(s) + H2(g) 的平衡常数为K2。在不同温度下,K1和K2的值如下:
FeO(s) + H2(g) 的平衡常数为K2。在不同温度下,K1和K2的值如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(1)现有反应③ H2(g) + CO2(g)  H2O(g) + CO(g),写出该反应的平衡常数K3的数学表达式K3=______________,根据反应①与②,可推导出K1、K2和K3之间的关系式为______________。
H2O(g) + CO(g),写出该反应的平衡常数K3的数学表达式K3=______________,根据反应①与②,可推导出K1、K2和K3之间的关系式为______________。
(2)从上表和K1、K2和K3之间的关系可以推断:反应①是___________(填“吸”、“ 放”,下同)热反应,反应③是___________热反应。
(3)图表示该反应③在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:
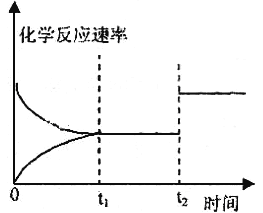
①图中时刻t2时改变的条件是_________(写出一种即可),
②973K时测得反应①中CO2和CO 的浓度分别为0.025mol/L和0.1mol/L,此时反应①是否处于化学平衡状态_______(选填“是”或“否”), 化学反应速度υ(正)_________υ(逆)(选填“>”、“<”或“=”)。
-
设反应①Fe(S)+CO2(g)  FeO(S)+CO(g)的平衡常数为
FeO(S)+CO(g)的平衡常数为 。反应②Fe(S)+H2O(g)
。反应②Fe(S)+H2O(g)  FeO(S)+H2(g)的平衡常数为
FeO(S)+H2(g)的平衡常数为 ,在不同温度下,
,在不同温度下, 、
、 的值如下:
的值如下:
| 温度 | 
| 
|
| 
| 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)从上表可以推断:反应①是_______________ (填“吸”、“放”)热反应。
(2)现有反应③H2(g)+CO2(g)  H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K
H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K =____________。
=____________。
(3)根据反应①与②,可推导出K 、K
、K 与K
与K 之间的关系式_______________。据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_____________(填写序号)。
之间的关系式_______________。据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_____________(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)图l、2表示该反应③在时刻t 达到平衡、在时刻t
达到平衡、在时刻t 分别因改变某个条件而发生变化的情况:
分别因改变某个条件而发生变化的情况:
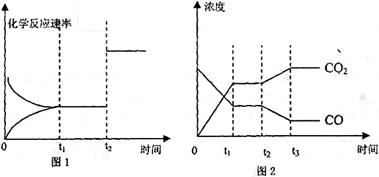
①图l中时刻t 发生改变的条件是_____________________________
发生改变的条件是_____________________________
②图2中时刻t 发生改变的条件是________________
发生改变的条件是________________
-
已知化学反应①:Fe(s)+CO2(g)=FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)=FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(1)通常表格中的数值可以推断:反应①是______(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=______.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式______.据此关系式及上表数据,也能推断出反应③是______(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______(填写序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的浓度.
-
(14分)(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应CO2(g)+ H2(g) CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g)
CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g) CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g)+ H2(g) CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O
D.c(CO)= c(CO2)
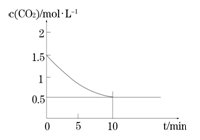
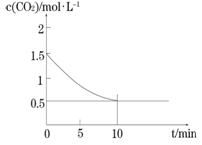
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
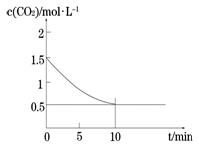
①该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时 增大的是____________(填序号)。
增大的是____________(填序号)。
A.升高温度
B.增大压强
C.充入一定量的CO2
D.再加入一定量铁粉
-
(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反应CO2(g) + H2(g) CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
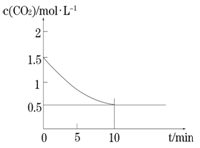
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时 增大的是__________(填序号)。
增大的是__________(填序号)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
-
(17分)已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)  FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1 173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1 173 K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)  CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________,根据反应①与②可推导出K1、K2与K3之间的关系式________,据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________,根据反应①与②可推导出K1、K2与K3之间的关系式________,据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动同时υ正增大可采取的措施
有(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
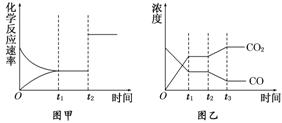
①图甲中t2时刻发生改变的条件是________。②图乙中t2时刻发生改变的条件是________。
(5)在830℃温度下,反应③的K值为1,在2 L的密闭容器中,加入1 mol CO2和3 mol H2充分反应达平衡时,CO平衡浓度为________ mol/L。H2转化率________。若向容器中再加入1 mol CO2和3 mol H2 达到平衡后CO平衡浓度________mol/L ,CO2体积分数
-
(9分)已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1173 K | 2.15 | 1.67 |
请填空:
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g) CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________.
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式________,据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有________(填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
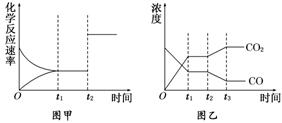
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是_____________________________________.
②图乙中t2时刻发生改变的条件是_______________________________________.
FeO(s)+CO(g) △H1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
CO(g) + H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g)是 反(填“吸热”或“放热”)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
增大的是____(填序号)。






