-
以电石渣[主要成分Ca(OH)2和CaCO3]为原料制备KClO3的流程如图。
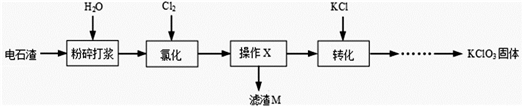
查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6 Ca(OH)2 + 6 Cl2 = Ca(ClO3)2 + 5CaCl2 + aH2O
(1)氯化前,先将电石渣粉碎的目的是___________。
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为_______________价,a数值为___________。
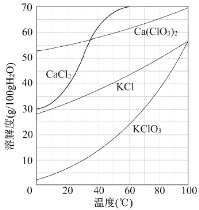
(3)操作X为______________。转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为_____________。(相关物质的溶解度见下图)
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)对滤渣M的成分进行探究
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③___________。
【实验验证】
| 实验步骤 | 实验现象 | 结论 |
| 步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入_______; | 观察到___________现象 | 猜想①不正确 |
| 步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到___________现象 | 猜想③正确 |
-
某兴趣小组对氯酸钾(KClO3)展开如下探究:
(探究一)工业制备KClO3
以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
(资料卡片):氯化时,主要反应为6Ca(OH)2 + 6X ═ Ca(ClO3)2 + 5CaCl2 + 6H2O,少量 X与Ca(OH)2反应生成Ca(ClO)2、CaCl2和H2O,Ca(ClO)2 分解为CaCl2和O2。
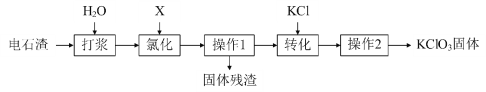
(1)根据资料,X的化学式为______,写出氯化时,X和Ca(OH)2反应生成Ca(ClO)2的化学方程式______。
(2)氯化时,为提高X转化为Ca(ClO3)2的转化率,下列措施可行的是______(填序号)。
A.充分搅拌浆料 B.加足量水使Ca(OH)2完全溶解 C.缓缓通入X
(3)操作1在实验室中的名称是______,需要用到的玻璃仪器有______、______和玻璃棒,玻璃棒的作用是______。氯化过程控制电石渣过量,固体残渣的主要成分为______和______(填化学式)。
(4)操作1后得到溶液中Ca(ClO3)2与CaCl2的化学计量数之比______1:5(填“>”、“<”或“=”)。转化时,加入KCl发生反应的化学方程式为______。
(5)操作2包含一系列实验操作,结合如图分析,主要操作为蒸发浓缩 →______→过滤→洗涤→低温烘干。
(探究二)探究KClO3制氧气
某小组利用如图所示装置对KClO3制氧气进行了探究:

(资料卡片):
①KClO3的熔点约为356℃,MnO2在加热条件下不分解。
②KClO3分解时,传感器得到氧气浓度随温度的变化示意图及使用不同催化剂时的固体残留率示意图如下:
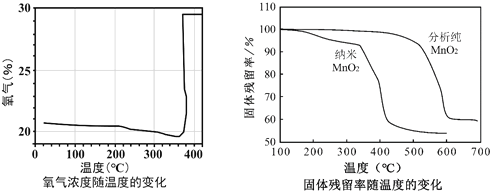
(6)由图可知KClO3分解温度______(填“高于”、“等于”或“低于”)其熔点。
(7)图中,在KClO3分解前,传感器测得氧气浓度降低的原因可能是______。
(8)分析图中,对KClO3分解催化效果更好的催化剂是______。
(9)将3.06gKClO3和MnO2混合物以4:1配比加热至完全反应,可得氧气体积约为多少升____?(写出计算过程,计算时精确到小数点后两位。已知氧气密度约为1.43g / L。)
-
过氧化钙(CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为 Ca(OH)2,含少量 CaCO3] 为原料制备 CaO2 的一种工艺流程如图甲所示:
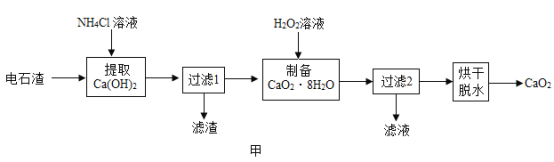
(查阅资料)Ⅰ.Ca(OH)2+2NH4Cl=CaCl2+2NH3•H2O
Ⅱ.CaCl2+2NH3•H2O+H2O2+6H2O=CaO2•8H2O↓+2NH4Cl
Ⅲ.CaO2•8H2O在水中不太稳定,会缓慢分解
(1)CaO2 与 CO2 反应除了生成氧气外、还生成一种常见的盐,写出反应的化学方程式___________。
(2)“提取 Ca(OH)2”时反应的基本类型是__________________;Ca(OH)2 的俗名为___________________;“过滤 1”所得滤渣的主要成分是______________。
(3)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“一贴”指的是滤纸紧贴漏斗壁, 原因是_______________________。实验室粗略测定溶液的酸碱度,常使用(填名称)_________________。
(4)在其他条件不变的情况下,制备 CaO2·8H2O 的反应时间(t)对其产率(ω )的影响如图乙所示。

①平均反应速率最快的时间段为___________。
②30min 后,ω 开始下降的主要原因是_________________。
(5)为了测定加入的 NH4Cl 溶液中溶质的质量分数,取 107.0gNH4Cl 溶液于烧杯中,加入稍过量的 AgNO3 溶液,完全反应后过滤、洗涤、干燥、称量, 得到14.35 g 白色固体。通过计算确定该溶液中NH4Cl 的质量分数为________。(精确到 0.1%)
-
过氧化钙(CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为Ca(OH)2,含少量CaCO3]为原料制备过氧化钙的一种工艺流程如图所示。请按要求回答下列问题:
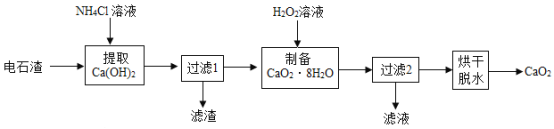
(查阅资料)
Ⅰ、Ca(OH)2+2NH4Cl=CaCl2+2NH3·H2O;
Ⅱ、CaCl2+2NH3·H2O+H2O2+6H2O=CaO2·8H2O↓+2NH4Cl;
Ⅲ、CaO2·8H2O在水中不稳定,会缓慢分解。
(1)Ca(OH)2的俗名为_____,“过滤1”所得滤渣的主要成分为_____,过氧化钙中氧元素的化合价为_____价。
(2)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“一贴”指的是_____。生产过程中为了精确测定溶液的pH,常使用_____(填仪器名称)。
(3)在其他条件不变的情况下,制备CaO2·8H2O的反应时间(t)与产率(ω)的关系如图所示:
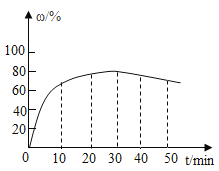
①平均反应速率最快的时间段为_____(填字母)。
a、0~10min
b、10~20min
c、20~30min
d、30~40min
②30min后,产率开始下降的主要原因是_____。
-
过氧化钙( CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为Ca(OH)2,含少量CaCO3]为原料制备CaO2的一种工艺流程如下:
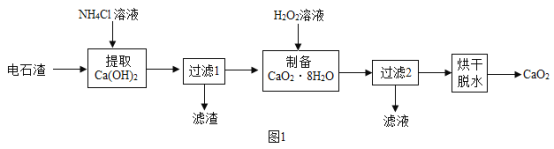
(查阅资料)I. Ca(OH)2+2NH4Cl=CaCl2+2NH3·H2O
Ⅱ.CaCl2+2NH3·H2O+H2O2 +6H2O= CaO2·8H2O↓+ 2NH4Cl
Ⅲ. CaO2·8H2O在水中不太稳定,会缓慢分解。
(1)“提取Ca(OH)2”时反应的基本类型是_______;Ca(OH)2的俗名为_______;“过滤1”所得滤渣的主要成分是_______。
(2)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“二低”指的是:滤纸边缘略低于漏斗口、_______。生产过程中为了精确测定溶液的pH,常使用_______ (填仪器名称)。
(3)在其他条件不变的情况下,制备CaO2·8H2O的反应时间(t)对其产率(w)的影响如图所示。
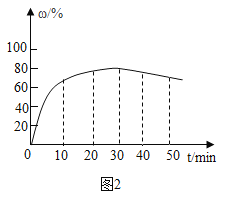
①平均反应速率最快的时间段为:_______ (填字母)。
a. 0~10min b. 10~20min c. 20~30min d.30~40min
②30min后,w开始下降的主要原因是_______。
(4)为了测定加入的NH4Cl溶液中溶质的质量分数,取30.00g NH4Cl溶液于烧杯中,加入稍过量的AgNO3溶液,完全反应后过滤、洗涤、干燥、称量,得到14.35g 白色固体。通过计算确定该溶液中NH4Cl的质量分数(精确到0.1%)____。
-
过氧化钙( CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为Ca(OH)2,含少量CaCO3]为原料制备CaO2的一种工艺流程如下:
(查阅资料)I. Ca(OH)2+2NH4Cl=CaCl2+2NH3·H2O
Ⅱ.CaCl2+2NH3·H2O+H2O2 +6H2O= CaO2·8H2O↓+ 2NH4Cl
Ⅲ. CaO2·8H2O在水中不太稳定,会缓慢分解。
(1)“提取Ca(OH)2”时反应的基本类型是_______;Ca(OH)2的俗名为_______;“过滤1”所得滤渣的主要成分是_______。
(2)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“二低”指的是:滤纸边缘略低于漏斗口、_______。生产过程中为了精确测定溶液的pH,常使用_______ (填仪器名称)。
(3)在其他条件不变的情况下,制备CaO2·8H2O的反应时间(t)对其产率(w)的影响如图所示。
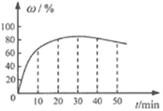
①平均反应速率最快的时间段为:_______ (填字母)。
a. 0~10min b. 10~20min c. 20~30min d.30~40min
②30min后,w开始下降的主要原因是_______。
(4)为了测定加入的NH4Cl溶液中溶质的质量分数,取30.00g NH4Cl溶液于烧杯中,加入稍过量的AgNO3溶液,完全反应后过滤、洗涤、干燥、称量,得到14.35g 白色固体。通过计算确定该溶液中NH4Cl的质量分数(精确到0.1%)____。
-
为实现废物“资源化”利用的目的,以电石渣[主要成份为Ca(OH)2和CaCO3.其中Ca(OH)2为微溶物]为原料制备KClO3,其主要流程如图所示:
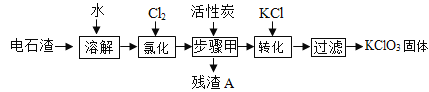
(1)氯化过程中,Cl2与Ca(OH)2作用,发生了一系列变化,最终生成Ca(ClO3)2和CaCl2,该反应的化学方程式中这两种生成物的化学计量数比为1:5
①生成Ca(CIO3)2的化学方程式______。
②提高Cl2转化为Ca(ClO2)2的转化率的可行措施有______(填标号)。
A 适当减缓通入Cl2速率 B 充分搅拌浆料 C 加水使Ca(OH)2完全溶解
(2)活性炭的作用是______;步骤甲的操作名称为______;残渣A中一定含有______。
(3)向步骤I得到的溶液中加入稍过量KCl固体可将Ca(ClO2)2转化为KClO3,该反应的基本反应类型为______。
-
为实现废物“资源化”利用的目的,以电石渣[主要成份为Ca(OH)2和CaCO3.其中Ca(OH)2为微溶物]为原料制备KClO3,其主要流程如图所示:

(1)氯化过程中,Cl2与Ca(OH)2作用,发生了一系列变化,最终生成Ca(ClO3)2和CaCl2,该反应的化学方程式中这两种生成物的化学计量数比为1:5
①生成 Ca(CIO3)2的化学方程式______。
②提高Cl2转化为Ca(ClO2)2的转化率的可行措施有______(填标号)。
A、适当减缓通入Cl2速率 B、充分搅拌浆料 C、加水使Ca(OH)2完全溶解
(2)活性炭的作用是______;步骤甲的操作名称为______;残渣A中一定含有______。
(3)向步骤I得到的溶液中加入稍过量KCl固体可将Ca(ClO2)2转化为KClO3,该反应的基本反应类型为______。
-
为实现废物“资源化”利用的目的,以电石渣[主要成份为Ca(OH)2和CaCO3.其中Ca(OH)2为微溶物]为原料制备KClO3,其主要流程如图所示:
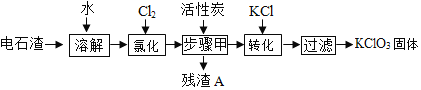
(1)氯化过程中,Cl2与Ca(OH)2作用,发生了一系列变化,最终生成Ca(ClO3)2和CaCl2,该反应的化学方程式中这两种生成物的化学计量数比为1:5
①生成 Ca(CIO3)2的化学方程式______。
②提高Cl2转化为Ca(ClO2)2的转化率的可行措施有______(填标号)。
A、适当减缓通入Cl2速率 B、充分搅拌浆料 C、加水使Ca(OH)2完全溶解
(2)活性炭的作用是______;步骤甲的操作名称为______;残渣A中一定含有______。
(3)向步骤I得到的溶液中加入稍过量KCl固体可将Ca(ClO2)2转化为KClO3,该反应的基本反应类型为______。
-
以某矿渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
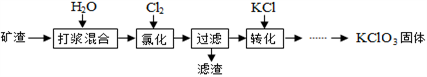
(1)打浆混合的目的是______________________。
(2)氯化过程控制矿渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2、CaCl2和H2O,写出该反应的化学方程式__________________,此反应_________置换反应(选填“属于”“不属于”); 其中Ca(ClO)2进一步转化为Ca(ClO3)2。
(3)氯化时矿渣稍过量的原因是__________________。
(4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O滤渣的主要成分是____________和______________CaCO3、Ca(OH)2填化学式)。
(5)已知:几种物质的溶解度曲线如图所示。
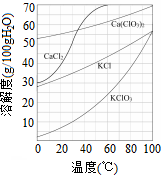
向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若从该溶液中尽可能多地析出KClO3固体的方法是___________、冷却结晶。

















