-
(10分)下表为周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)写出元素⑨的基态原子的电子排布式 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为________对。
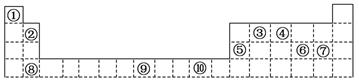
(4)第3周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填元素符号)。
-
(6分)下表为周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)写出元素⑨的基态原子的电子排布式 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为 对。
(4)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图中的序号)。
-
(11分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有 个,π键有 个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为 ,属于 分子(填“极性”或“非极性”)。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(7)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。


在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
-
下表为长式周期表的一部分,其中的编号代表对应的元素。


请回答下列问题:
(1)表中属于d区的元素是________(填编号);
(2)表中编号原子中,半径最小的是________(填元素符号,下同),第一电离能最小的是:________,电负性最大的是________;
电负性大小:⑤元素________④元素(填大于、等于或小于),第一电离能大小:⑤元素________④元素( 填大于、等于或小于)。
(3)某元素的价电子排布式为nsn-1npn+1,该元素原子的最外电子层的孤对电子数为________;该元素还可与元素①形成18电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,反应的离子方程式为:________;
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据:


表中的金属元素是________(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是________
________。
-
(15分)下表是长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
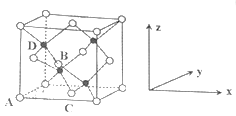
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为________(用对应的元素符号表示)。

(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是________。
a.分子中含有氢键 b.属于非极性分子
c.含有4个σ键和1个π键 d.该氢化物分子中,②原子采用sp2杂化
(4)某元素的外围电子排布式为nsnnpn+1,该元素可与①形成三角锥形的分子X, X在①与③形成的分子Y中的溶解度很大,其主要原因是
________。
(5)将过量的X通入含有元素⑩的硫酸盐溶液中,现象是________,反应的离子方程式_________。
(6) ⑩单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
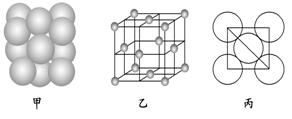
若已知⑩的原子半径为d,NA代表阿伏加德罗常数,⑩的相对原子质量为M,请回答:晶胞中⑩原子的配位数为________,该晶体的密度为________________(用字母表示)。
-
下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为________;
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是________(用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有________个,π键有________个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为________;该元素与元素①形成的分子X的空间构形为________,属于________分子(填“极性”或“非极性”)。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:________。
(7)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。


在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
-
下表为元素周期表的一部分,其中的编号代表对应的元素。
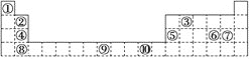
请回答下列问题:
(1)表中属于ds区的元素是________(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状物结构简式为________。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子数为________。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:_______________________。
(5)画出⑨的外围电子排布图____________________________.
-
如表为周期表的一部分,其中的编号代表对应的元素.
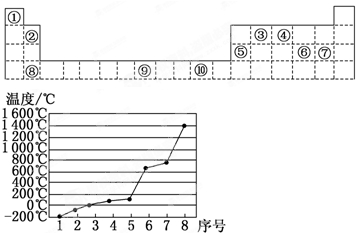
请回答下列问题:
(1)表中属于d区的元素是________(填编号).
(2)写出元素⑨的基态原子的电子排布式________.
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为________对.
(4)第3周期8种元素按单质熔点高低的顺序如图,
其中序号“8”代表________(填元素符号);
其中电负性最大的是________(填元素符号).
-
下表为长式周期表的一部分,其中的编号代表对应的元素。
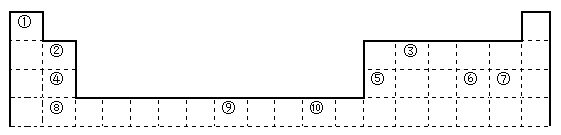
请回答下列问题:
(1)表中属于d区的元素是___________(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为_________。
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是___________(用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有______个,π键有______个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_______;该元素与元素①形成的分子X的空间构形为___________。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________。
-
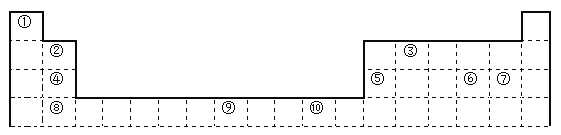
下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是___________(填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为_________。
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是___________(用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有______个,π键有______个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_______;该元素与元素①形成的分子X的空间构形为___________。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:__________________。
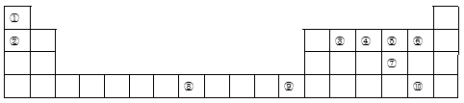
,0,
);C为(
,
,0)。则D离子(黑色球)的坐标参数为_____。