-
为探究原电池的形成条件和反应原理,某同学设计了如下图所示实验,连接装置后观察到铜片表面有气泡产生,小片乳一钢片灯泡发光。下列说法错误的是
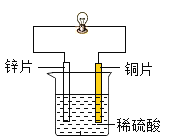
A.该反应的实质是锌原子把电子转移给了氢离子,被转移的电子沿导线定向移动形成电流
B.小灯泡发光证明化学反应可以产生电能
C.把图中的烧杯和所装稀硫酸溶液改为一个成熟的西红柿或柠檬等有酸味的果汁,将锌片和铜片平行插入其中,小灯泡也可能发光
D.铜片表面有气泡产生说明连接导线后铜与稀硫酸反应生成了氢气
九年级化学单选题中等难度题查看答案及解析
-
为探究原电池的形成条件和反应原理,某同学设计了如下图所示实验,连接装置后观察到铜片表面有气泡产生,小片乳一钢片灯泡发光。下列说法错误的是
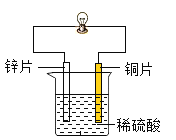
A.该反应的实质是锌原子把电子转移给了氢离子,被转移的电子沿导线定向移动形成电流
B.小灯泡发光证明化学反应可以产生电能
C.把图中的烧杯和所装稀硫酸溶液改为一个成熟的西红柿或柠檬等有酸味的果汁,将锌片和铜片平行插入其中,小灯泡也可能发光
D.铜片表面有气泡产生说明连接导线后铜与稀硫酸反应生成了氢气
九年级化学单选题中等难度题查看答案及解析
-
为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述稀硫酸中插入铜片,没有看到有气泡生成;
③将锌片与铜片上端用导线连接,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气 泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。 下列关于以上实验设计及现象的分析,不正确的是
A. 实验①、②说明锌能与稀硫酸反应而铜不能
B. 实验③说明发生原电池反应时会加快化学反应速率
C. 实验③说明在该条件下铜可以与稀硫酸反应生成氢气
D. 实验④说明该原电池中锌为负极、铜为正极,电子由锌沿导线流向铜
九年级化学单选题困难题查看答案及解析
-
铜片在潮湿的空气中久置,表面会产生绿色的铜锈。某小组同学设计并进行
实验,探究铜生锈的条件。

【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与铜片接触的物质,利用右图装置(铜片长
8cm,宽1cm,试管容积为20mL),分别进行下列7个实验,并持续观察30天。
编号
主要实验操作
实验现象
1
充满纯净的O2
铜片均无明显变化
2
充满纯净的CO2
3
充满经煮沸并迅速冷却的蒸馏水
4
加入蒸馏水5mL(液面未浸没铜片),再充满O2
5
加入经煮沸并迅速冷却的蒸馏水5 mL,再充满CO2
6
充入10mL O2,再充入10mLCO2
7
加入蒸馏水5ml,再依次充入10mL CO2和10mL O2
铜片生锈,且水面附近锈蚀最严重
【解释与结论】
(1)实验3中,要使用经煮沸并迅速冷却的蒸馏水,原因是_______。
(2)实验5的目的是_______。
(3)通过上述实验,得出铜生锈的条件是_______。
【反思与评价】
(4)请写出一种防止铜制品锈蚀的方法_______。
(5)查阅资料可知,铜锈的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3。由此,你认为上述实验中只需进行实验(填实验编号),就可探究出铜生锈条件,理由是_______。
(6)与以上进行的实验对比,你认为铜片在通常状况的空气中,生锈非常缓慢的原因
可能是_______。
九年级化学探究题困难题查看答案及解析
-
实验小组同学验证Ca(OH)2溶液导电性的实验装置如图1所示。实验观察到灯泡变亮的同时,两个电极上均有气体产生,且阳极附近出现了白色浑浊。小组同学对白色浑浊物的成分进行了如下探究。
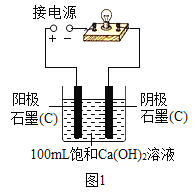
(猜想一)甲同学认为:白色浑浊物是Ca(OH)2。
(实验一)为了验证甲同学的猜想,进行如下实验。取少量白色浊液于试管中,加入足量水,充分振荡,观察到仍有白色浑浊。
(猜想二)乙同学认为:白色浑浊物中含有CaCO3。
(实验二)为了验证乙同学的猜想,进行如下实验。取少量白色浊液于试管中,滴加稀盐酸,白色浑浊消失,没有观察到有气泡产生。
(实验三)为了进一步验证乙同学的猜想,进行如下实验。
实验装置图
实验操作
实验现象
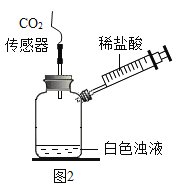
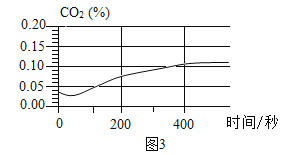
将注射器内稀盐酸推入瓶中,并用二氧化碳传感器测得装置内二氧化碳的体积分数
I.白色浑浊消失,没有观察到有气泡产生
II.检测到二氧化碳含量随时间的变化如下图所示
(解释与结论)
(1)用石墨电极验证Ca(OH)2溶液的导电性实验时,两个电极上产生大量气体,发生的是电解水的反应,写出反应的化学方程式________。
(2)甲同学提出白色浑浊为Ca(OH)2的理由是_____。
(3)由实验三得出的结论是____,相关反应的化学方程式为____。
(反思与交流)
(4)实验二中没有观察到明显气泡的可能原因是____。
(5)丙同学为了进一步探究白色浑浊物产生的原因,用铂(Pt)电极代替石墨(C)电极完成图1所示实验,其目的是________。
九年级化学科学探究题困难题查看答案及解析
-
实验台上提供了铁丝、锌片、铜片、稀盐酸、硫酸铜溶液、硝酸银溶液6种药品.为探究金属的活动性顺序,小红同学利用上述药品进行了如下的实验:
实验一:将锌片与铜片分别放入稀盐酸中,锌片表面有气泡产生,铜片无明显变化;
实验二:将铁丝放入硫酸铜溶液中,铁丝表面有红色物质生成;
实验三:将铜片放入硝酸银溶液中,铜片表面有银白色物质生成.
(1)小红的上述实验可得出的金属活动性关系是;
(2)要确定铁、锌、铜、银四种金属的活动性顺序,小红还应补充的实验是.九年级化学填空题中等难度题查看答案及解析
-
铜片在潮湿的空气中久置,表面会产生绿色的铜锈。某小组同学设计并进行实验,探究铜生锈的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与铜片接触的物质,利用如图装置(铜片长度为3 cm,试管容积为20 mL)分别进行下列5个实验,并持续观察30天。

编号
主要实验操作
实验现象
1
先充满用NaOH浓溶液洗涤过的空气
再加入2 mL浓硫酸
铜片始终无明显变化
2
先加入4 mL饱和Na2SO3溶液
再充满CO2
铜片始终无明显变化
3
加入2 mL NaOH浓溶液
铜片始终无明显变化
4
先加入2 mL浓硫酸
再通入约4 mL CO2
铜片始终无明显变化
5
先加入2 mL蒸馏水
再通入约4 mL CO2
铜片表面变成绿色
【解释与结论】
(1)实验中,NaOH浓溶液的作用是________(用化学方程式表示)。
(2)实验1的目的是________。
(3)实验2中,试管内的气体主要含有CO2、________。
(4)得出“铜生锈一定与H2O有关”的结论,依据的两个实验是________(填编号)。
(5)由上述实验可推知,铜片生锈的条件是________。
【反思与评价】
(6)在猜想与假设时,同学们认为铜生锈与N2无关,其理由是________。
(7)兴趣小组的同学认为不需进行上述实验,他们向铜锈中加入稀盐酸并把的气体通入澄清的石灰水变浑浊,即可得出铜生锈与空气中的二氧化碳有关。他们的依据是________。
九年级化学探究题困难题查看答案及解析
-
铜片在潮湿的空气中久置,表面会产生绿色的铜锈。某小组同学设计并进行实验,探究铜生锈的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与铜片接触的物质,利用下图装置(铜片长度为3 cm,试管容积为20 mL)分别进行下列5个实验,并持续观察30天。
编号
主要实验操作
实验现象
1
先充满用NaOH浓溶液洗涤过的空气
再加入2 mL浓硫酸
铜片始终无明显变化
2
先加入4 mL饱和Na2SO3溶液
再充满CO2
铜片始终无明显变化
3
加入2 mL NaOH浓溶液
铜片始终无明显变化
4
先加入2 mL浓硫酸
再通入约4 mL CO2
铜片始终无明显变化
5
先加入2 mL蒸馏水
再通入约4 mL CO2
铜片表面变成绿色
【解释与结论】
(1)实验中,NaOH浓溶液的作用是___________(用化学方程式表示)。
(2)实验1的目的是________。
(3)实验2中,试管内的气体主要含有CO2、________。
(4)得出“铜生锈一定与H2O有关”的结论,依据的两个实验是________(填编号)。
(5)由上述实验可推知,铜片生锈的条件是_________________。
【反思与评价】
(6)在猜想与假设时,同学们认为铜生锈与N2无关,其理由是________。
(7)兴趣小组的同学认为不需进行上述实验,他们向铜锈中加入稀盐酸并把生成的气体通入___。
九年级化学探究题困难题查看答案及解析
-
某兴趣小组同学为了验证铜、铁、银的金属活动性强弱,进行了如下的实验研究。
实验设计
甲
乙
丙
实验现象
观察到现象 (8)
铁丝表面有气泡产生
铜丝表面无气泡产生
实验结论
金属活动性:铁 > 铜 > 银
①实验前需要配制10%的稀硫酸,用到仪器有烧杯、量筒、胶头滴管,还缺少的一种仪器是(9) 。量取蒸馏水体积时,若仰视读数,则会导致硫酸溶质质量分数 (10) 10%(填“>”“<”、“=”)。
②铁丝与稀硫酸反应一段时间后剩余的溶液中,可能含有的溶质是 (11) ,为了确定可能含有的溶质,可加入 (12) (填选项序号)
A.铁 B.氯化钡溶液 C.氯化钠溶液 D.氢氧化铜
③ 拓展应用:硫酸铜溶液和熟石灰混合,可制农药波尔多液。不能用铁制容器盛放波尔多液的原因是 (13) (用化学方程式表示)
九年级化学填空题中等难度题查看答案及解析
-
在盐酸除铁锈的实验中,我们常会发现生锈的铁钉表面有一些气泡产生。气泡是怎么产生的?针对这一问题,同学 们提出了有关假设,并设计了如图甲所示的实验方案进行探究。实验时,观察到放有铁的试管中有气泡产生,而另一试管中没有,从而验证了自己的假设是成立的。
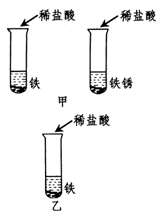
(1)分析上述实验,你认为同学们建立的假设是 。
(2)有同学认为上述实验不够严谨,溶液中的水可能会对实验产生影响。于是他们又进行了对照实验,请你在答题卷的虚线框中用图示的形式将图乙的对照实验补充完整。
(3)还有同学想:气体会不会是铁锈与水反应产生的?他认为还要补充一个铁锈与水反应的实验,你觉得有没有必要? 。
九年级化学简答题困难题查看答案及解析